Cách nhận biết alkene nhanh nhất
Bài tập nhận biết, phân biệt alkene là bài tập khá phổ biến trong chương trình hóa học phổ thông. Bài tập thường hỏi về cách nhận biết, phân biệt alkene với các hydrocarbon khác hoặc các dẫn xuất của hydrocarbon. Bài viết dưới đây sẽ hướng dẫn bạn cách nhận biết, phân biệt alkene chính xác và nhanh nhất.
Cách nhận biết alkene
I. Cách nhận biết alkene
- Để nhận biếtalkene ta sử dụng dung dịch brom (Br2) hoặc dung dịch thuốc tím (KMnO4). alkene sẽ làm mất màu nâu đỏ của dung dịch Br2 hoặc làm mất màu màu tím của dung dịch KMnO4.
- Nhận biết alkene bằng dung dịch brom
+ Tổng quát: CnH2n + Br2 → CnH2nBr2
+ Hiện tượng: Khi alkene phản ứng với dung dịch brom ở nhiệt độ thường thấy màu nâu đỏ của dung dịch brom nhạt dần, nếu alkene dư dung dịch mất màu.
+ Phương trình hóa học minh họa:
CH2=CH2 + Br2(màu nâu đỏ) → CH2Br-CH2Br (không màu)
CH3-CH=CH-CH3 + Br2 (màu nâu đỏ) → CH3-CHBr-CHBr-CH3 (không màu)
+ Giải thích: Phản ứng xảy ra do dung dịch brom tham gia phản ứng cộng ̣̣(phá vỡ liên kết π trong alkene).
- Nhận biết alkene bằng dung dịch KMnO4
+ Tổng quát: 3CnH2n+2KMnO4+ 4H2O → 3CnH2n(OH)2+2MnO2↓+2KOH
+ Hiện tượng: Khi alkene phản ứng với dung dịch KMnO4 ở nhiệt độ thường thấy màu của dung dịch KMnO4 nhạt dần và có kết tủa đen MnO2.
+ Phương trình hóa học minh họa:
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO-CH2-CH2-OH + 2MnO2↓ + 2KOH
+ Giải thích: Do xảy ra phản ứng oxi hóa không hoàn toàn giữa alkene và dung dịch KMnO4
Chú ý:
- Những phương pháp trên có thể dùng để nhận biết alkene và alkane.
- cycloalkane vòng ba cạnh cũng có khả năng làm mất màu dung dịch brom (phản ứng cộng mở vòng)
- Những phương pháp trên không dùng để nhận biết alkene với các hợp chất không no có liên kết C=C, C ≡ C.
II. Mở rộng
- Nhận biết alkene với ank-1-yne bằng dung dịch AgNO3/NH3.
Các ank-1-yne phản ứng sẽ tạo kết tủa màu vàng. alkene không có phản ứng này.
+ Phương trình hóa học:
CH ≡ C-CH3 + AgNO3 + NH3 → CAg ≡ C-CH3↓vàng + NH4NO3
III. Bài tập nhận biết alkene
Bài 1:Có hai bình mất nhãn đựng hai khí không màu là methane và etilen. Trình bày phương pháp hóa học phân biệt hai bình khí.
Huướng dẫn giải:
Dẫn lần lượt từng khí qua ống nghiệm đựng dung dịch brom, khí nào làm brom nhạt màu là etilen:
CH2=CH2 + Br2(màu nâu đỏ) → CH2Br-CH2Br (không màu)
Khí không làm brom nhạt màu là methane
Bài 2: Phân biệt các khí sau: N2, H2, CH4, C2H2, C2H4, chứa trong các bình mất nhãn.
Hướng dẫn giải:
Nhận xét:
- N2: không cho phản ứng cháy.
- H2: đốt cháy, sản phẩm cháy không làm đục nước vôi trong.
- CH4: đốt cháy, sản phẩm cháy làm đục nước vôi trong.
- Các khí còn lại dùng các phản ứng đặc trưng để nhận biết.
Cách nhận biết:
- Cho các khí tác dụng với dung dịch AgNO3/NH3. Khí nào tạo được kết tủa vàng là C2H2.
CH ≡ CH + 2AgNO3 + 2NH3 → CAg ≡ CAg↓ + 2NH4NO3
- Dẫn các khí còn lại qua dung dịch nước brom (màu nâu đỏ). Khí nào làm nhạt màu nước brom là C2H4.
H2C=CH2 + Br2 → BrH2C-CH2Br
- Lần lượt đốt cháy 3 khí còn lại, sau đó dẫn sản phẩm cháy qua bình đựng nước vôi trong.
+ Khí không cháy là N2.
+ Khí cháy, cho sản phẩm cháy nào làm đục nước vôi trong là CH4.
CH4 + 2O2 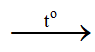 CO2 + 2H2O
CO2 + 2H2O
CO2 + Ca(OH)2 → CaCO3↓ +H2O
+Khí cháy, sản phẩm cháy không làm đục nước vôi trong là H2.
2H2 + O2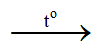 2H2O
2H2O
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



