Cấu hình electron của Cl, chlorine (clo) chương trình mới
Bài viết hướng dẫn cách viết Cấu hình electron của Cl, chlorine (clo) theo chương trình sách mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Cấu hình electron của Cl, chlorine (clo).
Cấu hình electron của Cl, chlorine (clo) chương trình mới
Nguyên tố chlorine có kí hiệu hóa học là Cl, số hiệu nguyên tử Z = 17. Bài viết dưới đây sẽ giúp các em viết cấu hình electron của nguyên tử chlorine, biểu diễn cấu hình electron của chlorine theo ô orbital, từ đó suy ra được vị trí trong bảng tuần hoàn và tính chất hóa học của nguyên tố này.
1. Cấu hình electron nguyên tử chlorine (Z = 17)
- Chlorine có số hiệu nguyên tử là 17 ⇒ nguyên tử Cl có 17 electron.
- Cấu hình electron nguyên tử chlorine là 1s22s22p63s23p5.
Viết gọn: [Ne]3s23p5.
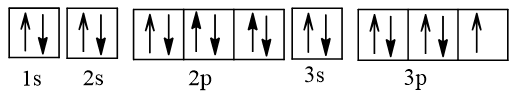
2. Cấu hình electron nguyên tử chlorine (Z = 17) theo ô orbital.
- Cấu hình electron nguyên tử chlorine (Z = 17) theo ô orbital là:
- Ở trạng thái cơ bản nguyên tử Cl có 1 electron độc thân, thuộc AO 3p.
3. Mối quan hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí Cl trong bảng tuần hoàn:
Từ cấu hình electron của Cl là 1s22s22p63s23p5 ta xác định được:
+ Chlorine thuộc ô thứ 17 (do Z = 17);
+ Chu kì 3 (do có 3 lớp electron),
+ Nhóm VIIA (do có 7 electron hóa trị, nguyên tố p).
+ Là nguyên tố p (do có cấu hình electron lớp ngoài cùng là 3s23p5).
- Tính chất nguyên tố:
+ Cl thuộc nhóm VIIA nên Cl là phi kim điển hình.
⇒ Cl có xu hướng nhận thêm 1 electron để đạt cấu hình bền của khí hiếm gần nó nhất là Ar.
Cl + e ⟶ Cl–
+ Công thức oxide cao nhất: Cl2O7 (là acidic oxide)
+ Công thức hydroxide tương ứng: HClO4 (là acid có tính oxi hóa mạnh)
+ Công thức hợp chất khí với hydrogen: HCl (là acid mạnh)
4. Ví dụ
Câu 1. Nguyên tố Cl (Z = 17) thuộc nhóm VIIA, có số electron hóa trị là
A. 4
B. 5
C. 6
D. 7
Lời giải:
Đáp án đúng là: D
Số electron hóa trị = số thứ tự nhóm A.
Nguyên tố Cl (Z = 17) thuộc nhóm VIIA ⇒ Có số electron hóa trị là 7
Câu 2. Nguyên tố chlorine ở chu kì 3, nhóm VIIA trong bảng tuần hoàn. Cấu hình electron nguyên tử của chlorine là
A. [Ne]3s23p3
B. [Ar]4s1
C. [Ne]3s23p5
D. [Ne]3s23p7
Hướng dẫn giải
Đáp án đúng là: C
Nguyên tố chlorine ở chu kì 3 ⇒ có 3 lớp electron.
Nhóm VIIA ⇒ có 7 electron lớp ngoài cùng
⇒ Cấu hình electron lớp ngoài cùng là: 3s23p5.
⇒ Cấu hình electron: [Ne]3s23p5
Câu 3. Nguyên tố Y (Z = 17). Trong bảng tuần hoàn, Y thuộc nhóm
A. IIIA
B. VIIA
C. IIIB
D. VA
Hướng dẫn giải
Đáp án đúng là: B
Nguyên tố Y (Z = 17) ⇒ Cấu hình electron: 1s22s22p63s23p5
Số thứ tự nhóm A = số electron lớp ngoài cùng = 2 + 5 = 7
Vậy Y thuộc nhóm VIIA.
Xem thêm cách viết cấu hình electron của các ion hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



