Cấu hình electron của F, fluorine (flo) chương trình mới
Bài viết hướng dẫn cách viết Cấu hình electron của F, fluorine (flo) theo chương trình sách mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Cấu hình electron của F, fluorine (flo).
Cấu hình electron của F, fluorine (flo) chương trình mới
Fluorine (flo) là nguyên tố có tính oxi hóa mạnh nhất trong các nguyên tố. Fluorine có kí hiệu hóa học là F, số hiệu nguyên tử Z = 9. Vậy cấu hình electron của fluorine được biểu diễn như thế nào? Cách phân bố electron trên ô orbital ra sao? Giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố fluorine có mối liên hệ như thế nào? Mời các em cùng tham khảo bài viết sau.
1. Cấu hình electron nguyên tử fluorine (Z = 9)
- Fluorine (flo) có số hiệu nguyên tử là 9 ⇒ nguyên tử F có 9 electron.
- Cấu hình electron nguyên tử flo là 1s22s22p5.
Viết gọn: [He]2s22p5.
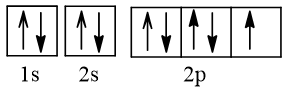
2. Cấu hình electron nguyên tử fluorine (Z = 9) theo ô orbital.
- Cấu hình electron nguyên tử fluorine (Z = 9) theo ô orbital là:
- Ở trạng thái cơ bản nguyên tử F có 1 electron độc thân, thuộc AO 2p.
3. Mối liên hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí F trong bảng tuần hoàn:
Từ cấu hình electron của F là 1s22s22p5 xác định được:
+ F thuộc ô thứ 9 (do Z = 9)
+ Chu kì 2 (do có 2 lớp electron)
+ Nhóm VIIA (do có 7 electron hóa trị, nguyên tố p).
+ Là nguyên tố p (do có cấu hình electron lớp ngoài cùng là 2s22p5).
- Tính chất nguyên tố:
+ F có 7 electron ở lớp ngoài cùng nên F là phi kim, F nằm ở đầu nhóm VIIA (nhóm các nguyên tố halogen) nên F là phi kim hoạt động mạnh nhất.
+ F có xu hướng nhận 1 electron khi tham gia phản ứng hóa học để đạt cấu hình bền vững của Ne.
F + 1e ⟶ F-
+ Công thức hợp chất với hydrogen: HF (HF tan trong nước tạo dung dịch axit yếu)
4. Ví dụ
Câu 1: Nguyên tử của nguyên tố A có tổng số electron trên phân lớp p là 5. Cấu hình electron của A là
A. 1s22s22p53s2.
B. 1s22s22p53s1.
C. 1s22s22p5.
D. 1s22s32p5.
Lời giải:
Đáp án đúng là: C
Tổng số electron trên phân lớp p là 5.
⇒ Cấu hình electron của A là 1s2 2s2 2p5.
Câu 2. Sự phân bố electron nguyên tử của một nguyên tố như sau: Y (2, 7). Vị trí nguyên tố này trong bàng tuần hoàn là:
A. ô số 7, chu kì 7, nhóm IIA.
B. ô số 7, chu kì 2, nhóm VIIA.
C. ô số 9, chu kì 2, nhóm VIIA.
C. ô số 9, chu kì 7, nhóm IIA.
Lời giải:
Đáp án đúng là: C
Nguyên tố Y có 2 + 7 = 9 electron được phân bố trên 2 lớp, lớp thứ nhất chứa 2 electron, lớp thứ 2 (lớp ngoài cùng) chứa 7 electron.
⇒ Y thuộc ô số 9, chu kì 2, nhóm VIIA.
Xem thêm cách viết cấu hình electron của các ion hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



