Cấu hình electron của Li, lithium (liti) chương trình mới
Bài viết hướng dẫn cách viết Cấu hình electron của Li, lithium (liti) theo chương trình sách mới của ba bộ sách Kết nối tri thức, Cánh diều, Chân trời sáng tạo giúp học sinh dễ dàng nắm vững cách viết Cấu hình electron của Li, lithium (liti).
Cấu hình electron của Li, lithium (liti) chương trình mới
Cấu hình electron của nguyên tử lithium (liti) được viết như thế nào? Từ cấu hình electron của nguyên tử lithium sẽ giúp ta suy ra điều gì? Bài viết bên dưới sẽ giúp các em giải quyết những thắc mắc trên.
1. Cấu hình electron nguyên tử lithium (Z = 3)
- Lithium có kí hiệu hóa học là Li. Số hiệu nguyên tử Z = 3
⇒ Nguyên tử Li có 3 electron.
- Cấu hình electron nguyên tử lithium là 1s22s1.
Viết gọn: [He]2s1.
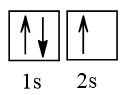
2. Cấu hình electron nguyên tử lithium (Z = 3) theo ô orbital.
- Cấu hình electron nguyên tử lithium (Z = 3) theo ô orbital là:
- Nguyên tử Li có 1 electron độc thân, thuộc AO 2s.
3. Mối liên hệ giữa cấu hình electron với vị trí trong bảng tuần hoàn và tính chất nguyên tố
- Vị trí Li trong bảng tuần hoàn:
Từ cấu hình electron của Li là 1s22s1 sẽ xác định được:
+ Li thuộc ô thứ 3 (do Z = 3).
+ Chu kì 2 (do có 2 lớp electron).
+ Nhóm IA (do có 1 electron hóa trị, nguyên tố s).
+ Là nguyên tố s (do cấu hình electron lớp ngoài cùng là 2s1).
- Tính chất nguyên tố:
+ Li thuộc nhóm IA ⇒ là kim loại kiềm.
+ Li có 1 electron ở lớp ngoài cùng, có xu hướng nhường đi 1 electron này khi hình thành liên kết hóa học để đạt cấu hình bền vững của khi hiếm He ⇒ Li có tính khử mạnh.
+ Hóa trị cao nhất với oxygen: I
+ Công thức oxide cao nhất: Li2O (là basic oxide)
+ Công thức base tương ứng: LiOH (là base mạnh)
4. Ví dụ
Câu 1: Nguyên tử nguyên tố X có 1 electron duy nhất ở lớp thứ 2. Vị trí của X trong bảng tuần hoàn là
A. ô 1, chu kì 2, nhóm IVA.
B. ô 2, chu kì 2, nhóm IA.
C. ô 3, chu kì 2, nhóm IA.
D. ô 3, chu kì 3, nhóm VIIIA.
Lời giải:
Đáp án đúng là: C
Nguyên tử nguyên tố X có 1 electron duy nhất ở lớp thứ 2 ⇒ Cấu hình electron của X là:
1s22s1
Dựa vào cấu hình electron, suy ra:
+ X thuộc ô thứ 3 (do Z = 3);
+ X thuộc chu kì 2 (do có 2 lớp electron)
+ Nhóm IA (do có 1 electron hóa trị).
Câu 2: M là nguyên tố s. Tổng số hạt mang điện trong nguyên tử của nguyên tố M là 6. Số electron độc thân trong nguyên tử nguyên tố M là
A. 1
B. 2
C. 3
D. 4
Lời giải:
Đáp án đúng là: A
M là nguyên tố s nên M thuộc nhóm A.
Tổng số hạt mang điện trong nguyên tử của nguyên tố M là 6 ⇒ Số p = số e = 3
⇒ Cấu hình electron của M là 1s22s1.
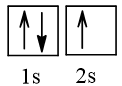
⇒ Cấu hình electron nguyên tử M theo ô orbital là:
⇒ Nguyên tử M có 1 electron độc thân, thuộc AO 2s.
Xem thêm cách viết cấu hình electron của các ion hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



