BaCO3 + HCl → BaCl2 + CO2 + H2O
Phản ứng BaCO3 + HCl ra BaCl2 và khí CO2 bay lên thuộc loại phản ứng trao đổi đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về BaCO3 có lời giải, mời các bạn đón xem:
BaCO3 + 2HCl → BaCl2 + CO2 ↑ + H2O
1. Phương trình phản ứng BaCO3 tác dụng với HCl
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
Phản ứng này thuộc loại phản ứng trao đổi.
2. Hiện tượng của phản ứng BaCO3 tác dụng với HCl
-Xuất hiện khí CO2 thoát ra khỏi dung dịch.
3. Cách tiến hành phản ứng BaCO3 tác dụng với HCl
- Cho từ từ dung dịch HCl vào ống nghiệm có chứa 1 mẩu BaCO3.
4. Cách viết phương trình ion thu gọn của phản ứng BaCO3 tác dụng với HCl
Bước 1: Viết phương trình phân tử:
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
BaCO3 + 2H+ + 2Cl- → Ba2+ + 2Cl- + H2O + CO2↑
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
BaCO3 + 2H+ → Ba2+ + H2O + CO2↑
5. Tính chất hoá học của HCl
Hydrochloric acid là một axit mạnh, mang đầy đủ tính chất hóa học của một axit như:
- Làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với kim loại đứng trước (H) trong dãy hoạt động hóa học của kim loại. Ví dụ:
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Chú ý: Kim loại có nhiều hóa trị tác dụng với dung dịch HCl thu được muối trong đó kim loại ở mức hóa trị thấp. Ví dụ:
Fe + 2HCl → FeCl2 + H2
- Tác dụng với basic oxide và bazơ tạo thành muối và nước. Ví dụ:
CuO + 2HCl CuCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
NaOH + HCl → NaCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Tác dụng với muối của axit yếu hơn tạo thành muối mới và axit mới. Ví dụ:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ↑
AgNO3 + HCl → AgCl↓ + HNO3
Ngoài tính chất đặc trưng là tính axit, dung dịch axit HCl đặc còn thể hiện tính khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3…
6. Tính chất của muối cabonat
Muối carbonate là muối của carbonic acid (gồm muối và ).
6.1. Tính tan
- Muối carbonate của các kim loại kiềm, amoni và đa số muối hydrocarbon?t dễ tan trong nước.
- Muối carbonate của kim loại khác thì không tan.
6.2. Tính chất hóa học
a) Tác dụng với axit
Thí dụ:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
+ H+ → CO2↑ + H2O
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
+ 2H+ → CO2↑ + H2O
b) Tác dụng với dung dịch kiềm
- Các muối hydrocarbon?t tác dụng dễ dàng với dung dịch kiềm.
Thí dụ:
NaHCO3 + NaOH → Na2CO3 + H2O
c) Phản ứng nhiệt phân
- Muối carbonate tan không bị nhiệt phân (trừ muối amoni), muối carbonate không tan bị nhiệt phân:
MgCO3 MgO + CO2↑
- Tất cả các muối hydrocarbon?t đều bị nhiệt phân:
2NaHCO3 → Na2CO3 + CO2↑ + H2O
Ca(HCO3)2 → CaCO3 + H2O + CO2↑
7. Bài tập vận dụng liên quan
Câu 1: Để tạo xốp cho một số loại bánh, có thể dùng muối nào sau đây?
A. (NH4)3PO4.
B. NH4HCO3.
C. CaCO3.
D. NaCl.
Hướng dẫn giải:
Đáp án B
NH4HCO3 NH3↑ + CO2↑ + H2O
Khi sử dụng bột nở này, khí NH3 và CO2 thoát ra làm cho bánh căng phồng và xốp.
Câu 2: Cặp chất nào sau đây không bị nhiệt phân?
A. CaCO3, BaCO3.
B. Ca(HCO3)2, Ba(HCO3)2.
C. Na2CO3, K2CO3.
D. NaHCO3, KHCO3.
Hướng dẫn giải:
Đáp án C
Muối carbonate của kim loại kiềm bền với nhiệt.
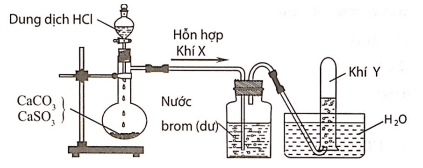
Câu 3:Hình vẽ sau đây mô tả thí nghiệm điều chế và thu khí Y từ hỗn hợp rắn gồm CaCO3 và CaSO3:
Khí Y là
A. CO2.
B. SO2.
C. H2.
D. Cl2.
Hướng dẫn giải:
Đáp án A
Hỗn hợp khí X gồm CO2 và SO2. Khí SO2 khi đi qua bình đựng nước brom đã bị giữ lại, còn khí Y thoát ra là CO2.
Câu 4: Tro thực vật được sử dụng như một loại phân bón cung cấp nguyên tố kali cho cây trồng do chứa muối kali carbonate. Công thức của kali carbonate là
A. KCl.
B. KOH.
C. NaCl
D. K2CO3
Hướng dẫn giải:
Đáp án D
Công thức của kali carbonate là K2CO3.
Câu 5: Chất nào sau đây tác dụng với dung dịch NaHCO3 sinh ra khí CO2?
A. NaCl.
B. KNO3.
C. KCl.
D. HCl.
Hướng dẫn giải:
Đáp án D
HCl + NaHCO3 → CO2↑ + NaCl + H2O
Câu 6:Cho 10 gam CaCO3 vào dung dịch HCl dư, sau khi phản ứng xảy ra hoàn toàn thu được V lít CO2 (đktc). Giá trị của V là
A. 2,80.
B. 2,24.
C. 1,12.
D. 3,36.
Hướng dẫn giải:
Đáp án B
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Bảo toàn nguyên tố C ta có:
lít
Câu 7: Natri carbonate là hóa chất quan trọng trong công nghiệp thủy tinh, bột giặt, phẩm nhuộm, giấy, sợi. Công thức của natri carbonate là
A. Na2CO3.
B. NaHCO3.
C. MgCO3.
D. CaCO3.
Hướng dẫn giải:
Đáp án A
Công thức của natri carbonate là Na2CO3.
Câu 8:Nung CaCO3 ở nhiệt độ cao, thu được chất khí X. Chất X là
A. CaO.
B. H2.
C. CO.
D. CO2.
Hướng dẫn giải:
Đáp án D
Khí X là CO2:
CaCO3 CaO (rắn) + CO2 (khí).
Câu 9. Cho 20 gam hỗn hợp gồm Fe, FeO, Fe3O4, Fe2O3 tác dụng vừa hết với 700 ml HCl 1M thu được dung dịch X và 3,36 lít khí H2 (đktc). Cho X phản ứng với dung dịch NaOH dư thu được kết tủa Y. Nung Y ngoài không khí đến khối lượng không đổi thu được đến khối lượng không đổi được m(g) chất rắn. Tính m
A. 16,0 B. 23,4. C. 14,4 D. 24,0.
Hướng dẫn giải
Đáp án D
nHCl = 0,7 mol ;
- BTNT H:
- Lại có:
Vậy mrắn = 0,15.160 = 24 gam.
Câu 10. Đốt cháy hoàn toàn 5,8 gam hỗn hợp gồm Zn và Mg trong không khí thu được hỗn hợp oxit X. Hòa tan hết X trong dung dịch HCl 1M. Thể tích dung dịch axit HCl hòa tan hết được X là
A. 250 ml. B. 100 ml. C. 150 ml. D. 500 ml.
Hướng dẫn giải
Đáp án A
Sơ đồ phản ứng:
- Giả sử chỉ có Zn ⇒ nZn = 0,09 mol
⇒ nHCl = 0,18 ⇒ V = 180 ml
- Nếu chỉ có Mg ⇒ nMg = 0,24 mol
⇒ nHCl = 0,48 ⇒ V = 480 ml
⇒ 180 ml < VHCl < 480 ml ⇒ Chọn A.
Xem thêm các phương trình hóa học hay khác:
- BaCO3 + C → BaO + 2CO ↑
- BaCO3 + H2SO4 → H2O + CO2 ↑ + BaSO4 ↓
- Phản ứng nhiệt phân: BaCO3 → BaO + CO2 ↑
- BaCO3 + H2O + CO2 → Ba(HCO3)2
- BaCO3 + 2CH3COOH → H2O + CO2 ↑ + (CH3COO)2Ba
- BaCO3 + 2HNO3 → Ba(NO3)2 + H2O + CO2 ↑
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



