C6H5ONa + HCl → C6H5OH + NaCl
Phản ứng C6H5ONa + HCl tạo ra Phenol C6H5OH thuộc loại phản ứng thế ở vòng thơm đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về C6H5ONa có lời giải, mời các bạn đón xem:
C6H5ONa + HCl → C6H5OH + NaCl
1. Phương trình phản ứngC6H5ONa tác dụng với HCl
C6H5ONa + HCl → C6H5OH + NaCl
Phản ứng này thuộc loại phản ứng trao đổi.
2. Hiện tượng của phản ứng C6H5ONa tác dụng với HCl
- Cho dung dịch HCl vào dung dịch C6H5ONa dung dịch bị vẩn đục.
3. Cách tiến hành phản ứng C6H5ONa tác dụng với HCl
- Chodung dịch HCl vào ống nghiệm chứa 1 – 2 ml dung dịch C6H5ONa
4. Cách viết phương trình ion thu gọn của phản ứng C6H5ONa tác dụng với HCl
Bước 1: Viết phương trình phân tử:
C6H5ONa + HCl → C6H5OH + NaCl
Bước 2: Viết phương trình ion đầy đủ bằng cách: chuyển các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất điện li yếu, chất kết tủa, chất khí để nguyên dưới dạng phân tử:
C6H5O- + Na+ + H+ + Cl- → C6H5OH + Na+ + Cl-
Bước 3: Viết phương trình ion thu gọn từ phương trình ion đầy đủ bằng cách lược bỏ đi các ion giống nhau ở cả hai vế:
C6H5O- + H+ → C6H5OH
5. Mở rộng về phản ứng trao đổi trong dung dịch chất điện li
Xét phản ứng:
Dung dịch A + dung dịch B → Sản phẩm.
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion.
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion kết hợp được với nhau tạo thành ít nhất 1 trong số các chất sau:
+ Chất kết tủa.
+ Chất điện li yếu.
+ Chất khí.
Thí dụ:
+ Phản ứng tạo thành chất kết tủa:
K2SO4 + BaCl2 → 2KCl + BaSO4↓
+ Phản ứng tạo thành chất điện li yếu:
HCl + KOH → KCl + H2O
+ Phản ứng tạo thành chất khí:
Zn + H2SO4 loãng → ZnSO4 + H2↑
6. Bài tập vận dụng liên quan
Câu 1: Nhận xét nào sau đây đúng?
A. Phenol có tính axit mạnh hơn ethanol
B. Phenol có tính axit yếu hơn ethanol
C. Phenol dễ tan trong nước hơn trong dung dịch NaOH
D. Phenol không có tính axit.
Hướng dẫn giải:
Đáp án A
Loại C vì: Phenol ít tan trong nước
Loại D vì: Do ảnh hưởng của vòng benzene đến OH dẫn tới phenol có tính axit.
Loại B vì: Vòng benzene hút e của nhóm OH làm mật độ điện tích trên OH giảm, liên kết O-H phân cực mạnh hơn. Nguyên tử H của nhóm OH linh động hơn so với ancol nên phenol có tính axit mạnh hơn ethanol
Câu 2: Hãy chọn phát biểu sai:
A. Phenol có tính axit yếu nhưng mạnh hơn H2CO3.
B. Phenol là chất rắn kết tinh dễ bị oxi hóa trong không khí.
C. Khác với benzene, phenol phản ứng dễ dàng với Br2 tạo kết tủa trắng.
D. Nhóm –OH và gốc phenyl ở phenol có ảnh hưởng qua lại lẫn nhau.
Hướng dẫn giải:
Đáp án A
Phenol có tính axit yếu hơn cả H2CO3.
Câu 3: C6H5Cl . Tên gọi của hợp chất Z là:
A.1,3,5-tribromphenol
B.2,4,6-tribromphenol
C.3,5-dibromphenol
D. phenolbromua
Hướng dẫn giải:
Đáp án B
C6H5Cl + 2NaOH C6H5ONa (X) + NaCl + H2O
C6H5ONa + CO2 + H2O → C6H5OH (Y) + NaHCO3
Câu 4: Cho m gam hỗn hợp X gồm phenol và ethylic alcohol tác dụng với Na dư thu được 25,2 hỗn hợp muối. Cho m/10 gam lượng hỗn hợp X phản ứng vừa đủ với 10ml dung dịch NaOH 1M. Số mol của rượu và phenol là:
A. 0,1 và 0,1
B. 0,2 và 0,2
C. 0,2 và 0,1
D. 0,18 và 0,06
Hướng dẫn giải:
Đáp án C
C6H5OH + Na → C6H5ONa + 0,5 H2
x x mol
C2H5OH + Na → C2H5ONa + 0,5 H2
y y mol
C6H5OH + NaOH → C6H5ONa + H2O
0,01 0,01 mol
Ta có hệ phương trình:
Câu 5: Một hỗn hợp phenol và rượu thơm X đơn chức. Lấy 20,2 gam hỗn hợp này tác dụng với Na dư thu được 2,24 lít khí H2 ở đktc. Mặt khác, cũng 20,2 gam hỗn hợp này phản ứng vừa đủ với 50 ml dung dịch NaOH 2M. Công thức phân tử của X là
A. C7H8O
B.C4H8O
C.C6H6O
D.C6H6O2
Hướng dẫn giải:
Đáp án A
Gọi công thức phân tử của X là ROH
Chỉ có phenol tác dụng với NaOH
C6H5OH + NaOH → C6H5ONa + H2O
0,1 0,1 mol
Có nX = nNaOH → MX =R + 17 =108. X là rượu thơm.
Công thức phân tử của X là C7H8O.
Câu 6: Vì sao phenol có lực axit mạnh hơn ancol và phản ứng thế vào nhân thơm ở phenol dễ hơn ở benzene ?
A. Do phenol có phân tử khối lớn hơn
B. Do ảnh hưởng qua lại giữa gốc phenyl và nhóm OH
C. Do liên kết hidro
D. Cả A và C
Hướng dẫn giải:
Đáp án B
Đó là do ảnh hưởng qua lại giữa gốc phenyl và nhóm hiđroxyl như sau:
Cặp electron chưa tham gia liên kết của nguyên tử oxi do ở cách các electron π của vòng benzene chỉ một liên kết α làm cho mật độ electron dịch chuyển vào vòng benzene. Điều đó dẫn tới các hệ quả sau:
* Liên kết O−H trở nên phân cực hơn, làm cho nguyên tử H linh động hơn. Tính axit mạnh hơn ancol.
* Mật độ electron ở vòng benzene tăng lên, nhất là ở các vị trí o và p, làm cho phản ứng thế dễ dàng hơn so với benzene và đồng đẳng của nó.
* Liên kết C−O trở nên bền vững so với ở ancol, vì thế nhóm OH phenol không bị thế bởi gốc axit như nhóm OH ancol.
Câu 7: Để sơ cứu cho người bị bỏng phenol người ta sử dụng hóa chất nào sau đây?
A. glycerol
B. NaOH đậm đặc
C. H2SO4
D. NaCl
Hướng dẫn
Đáp án A
Phenol tan nhiều trong glycerol nên glycerol sẽ kéo dần phenol ra ngoài.
NaOH đậm đặc phản ứng với phenol nhưng là hóa chất gây ăn mòn da, không được sử dụng để sơ cứu.
Câu 8: Cho các hợp chất thơm đều có CTPT C7H8O lần lượt tác dụng được với Na và NaOH thì số chất phản ứng được với Na, NaOH và không tác dụng được với cả Na và NaOH lần lượt là
A. 4, 3, 1
B. 4, 4, 0
C. 3, 3, 1.
D. 4, 3, 0
Hướng dẫn giải:
Đáp án A
Các hợp chất thơm có CTPT C7H8O là:
+ Phenol: o, m, p - CH3C6H4OH
+ Ancol: C6H5CH2OH
+ Ete: C6H5OCH3
- Tác dụng với Na: o, m, p - CH3C6H4OH; C6H5CH2OH (4 chất)
- Tác dụng với NaOH: o, m, p - CH3C6H4OH (3 chất)
- Không tác dụng với NaOH và Na: C6H5OCH3 (1 chất)
Câu 9:Cho phenol (C6H5OH) lần lượt tác dụng với (CH3CO)2O và các dung dịch NaOH; HCl; Br2; HNO3; CH3COOH. Số trường hợp xảy ra phản ứng là:
A. 4
B. 2
C. 1
D. 3
Hướng dẫn giải:
Đáp án A
Có 4 chất phản ứng với phenol là: (CH3CO)2O; NaOH; HNO3; Br2
PTHH:
(CH3CO)2O + C6H5OH → CH3COOC6H5 + CH3COOH (phản ứng điều chế ester của phenol)
NaOH + C6H5OH → C6H5ONa + H2O
Câu 10: Phản ứng hóa học: C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3 (C6H5– là gốc phenyl) chứng tỏ:
A. Phenol có tính axit yếu hơn carbonic acid
B. Phenol có tính axit mạnh hơn carbonic acid
C. Phenol có tính oxi hóa mạnh hơn carbonic acid
D. Phenol có tính oxi hóa yếu hơn carbonic acid
Hướng dẫn giải:
Đáp án A
Phenol có tính axit yếu nó còn yếu hơn cả nấc 1 của axit H2CO3 và không làm đổi màu quỳ tím vì thế muối sodium phenolate bị CO2 và H2O đẩy ra khỏi dd tạo thành phenol.
Câu 11: Cho sơ đồ chuyển hóa sau:
Các chất X, Y, Z lần lượt là
A. C6H5Br , C6H5OH , C6H5Cl
B. C6H5Br , C6H5ONa , C6H5OH
C. C6H5Br , C6H5ONa , C6H5Cl
D. C6H5Br , C6H5OH , HOC6H2(Cl)3.
Hướng dẫn giải:
Đáp án B
PTHH:
C6H6 + Br2 C6H5Br + HBr
C6H5Br + 2NaOH C6H5ONa + H2O + NaBr
C6H5ONa + HCl → C6H5OH + NaCl
Xem thêm các phương trình hóa học hay khác:
- C6H5OH + NaOH → C6H5ONa + H2O
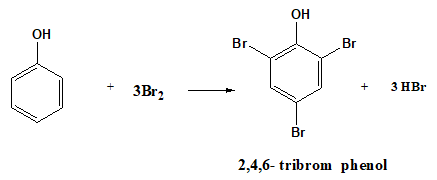
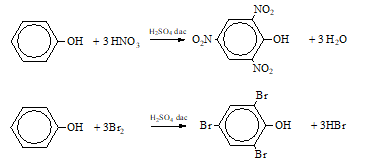
- C6H5OH + 3Br2 C5H2Br3OH + 3HBr
- 2C6H5OH + 2Na 2C6H5ONa + H2↑
- C6H5OH + 3HNO3 C6H2(NO2)3OH + 3H2O
- C6H5ONa + CO2 + H2O → C6H5OH + NaHCO3
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



