Mg(OH)2 → MgO + H2O ↑ | Mg(OH)2 ra MgO
Phản ứng nhiệt phân: Mg(OH)2 -to hay Mg(OH)2 ra MgO thuộc loại phản ứng phân hủy đã được cân bằng chính xác và chi tiết nhất. Bên cạnh đó là một số bài tập có liên quan về Mg(OH)2 có lời giải, mời các bạn đón xem:
Nhiệt phân: Mg(OH)2 -to→ MgO + H2O ↑
Điều kiện phản ứng
- nhiệt phân
Cách thực hiện phản ứng
- nhiệt phân Mg(OH)2
Hiện tượng nhận biết phản ứng
- Có hơi nước thoát ra, chất rắn sau phản ứng có khối lượng giảm so với ban đầu.
Bạn có biết
- Các bazơ không tan bị nhiệt phân hủy thành oxit tương ứng và nước.
Ví dụ minh họa
Ví dụ 1:
Nhiệt phân hoàn toàn Mg(OH)2 thu được sản phẩm là
A. Mg và H2O. C. MgO và H2O.
B. MgO và H2. D. MgH2 và O2.
Hướng dẫn giải:
Mg(OH)2 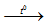
Đáp án C.
Ví dụ 2:
Nhiệt phân hoàn toàn 5,8g Mg(OH)2, kết thúc phản ứng thu được chất rắn có khối lượng là
A. 5g. B. 4g. C. 3g. D. 2g.
Hướng dẫn giải:
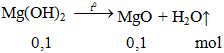
mcr sau = 0,1.40 = 4g.
Đáp án B.
Ví dụ 3:
Nhiệt phân hoàn toàn 5,8g Mg(OH)2 thu được chất rắn A. Hòa tan chất A bằng 500g dung dịch HCl 3,65%. Nồng độ phần trăm của dung dịch muối thu được sau phản ứng là
A. 1,88%. B. 2,00%. C. 2,88%. D. 4,00%.
Hướng dẫn giải:
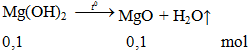
mMgO = 0,1.40 = 4g.
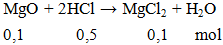
HCl dư
Áp dụng định luật bảo toàn khối lượng có: mdd sau = 4 + 500 = 504 gam.
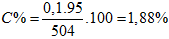
Đáp án A.
Xem thêm các phương trình hóa học hay khác:
- Mg(OH)2 + 2HCl → MgCl2 + 2H2O
- Mg(OH)2 + 2HBr → MgBr2 + 2H2O
- Mg(OH)2 + 2HNO3 → Mg(NO3)2 + 2H2O
- Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
- Mg(OH)2 + 2CH3COOH → (CH3COO)2Mg + 2H2O
- Mg(OH)2 + 2HCOOH → (HCOO)2Mg + 2H2O
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



