So sánh bán kính của Cl và Cl-
Bán kính nguyên tử clo và ion của nó có đặc điểm như thế nào? Bài viết sau sẽ giúp các em giải quyết vấn đề này.
So sánh bán kính của Cl và Cl-
1. So sánh
Bán kính nguyên tử clo nhỏ hơn bán kính ion Cl-.
Hình minh họa:
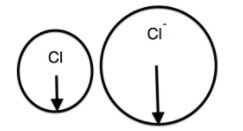
2. Giải thích
Ta có, cấu hình electron của ion Cl- là 1s2 2s2 2p6 3s2 3p6.
⇒ Nguyên tử phi kim Cl đã nhận 1 electron để hình thành anion Cl-.
⇒ Bán kính của anion Cl- lớn hơn bán kính của nguyên tử Cl.
Giải thích:
+ Cả nguyên tử Cl và ion Cl- đều có điện tích hạt nhân là 17+ nhưng nguyên tử Cl có 17 electron còn anion Cl- có 18 electron.
+ Khi có thêm electron ở lớp ngoài cùng, ion clorua có xu hướng nở ra do lực đẩy điện tử giữa nhau. Điều này làm tăng bán kính ion clorua hơn bán kính nguyên tử clo.
3. Ví dụ minh họa
Nhận xét nào sau đây là đúng?
A. Bán kính nguyên tử bao giờ cũng nhỏ hơn bán kính ion nguyên tử.
B. Bán kính ion Cl- lớn hơn bán kính nguyên tử clo.
C. Ion Cl- có 18 proton.
D. Bán kính của nguyên tử Cl và ion Cl- là bằng nhau.
Hướng dẫn giải
Đáp án đúng là: B
A sai, ví dụ bán kính ion Na+ nhỏ hơn bán kính nguyên tử Na.
C sai, ion Cl- có 18 electron.
D sai, bán kính ion Cl- lớn hơn bán kính nguyên tử Cl.
Xem thêm các bài viết về cách so sánh bán kính nguyên tử và ion hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



