Trắc nghiệm Hóa 10 Chân trời sáng tạo Bài 14 (có đáp án): Tính biến thiên enthalpy của phản ứng hóa học
Với 18 bài tập trắc nghiệm Hóa 10 Bài 14: Tính biến thiên enthalpy của phản ứng hóa học sách Chân trời sáng tạo có đáp án và lời giải chi tiết đầy đủ các mức độ, có đúng sai, trả lời ngắn sẽ giúp học sinh ôn luyện trắc nghiệm Hóa học 10.
Trắc nghiệm Hóa 10 Chân trời sáng tạo Bài 14 (có đáp án): Tính biến thiên enthalpy của phản ứng hóa học
PHẦN I. TRẮC NGHIỆM NHIỀU PHƯƠNG ÁN LỰA CHỌN
Câu 1. Sự phá vỡ liên kết cần ….. năng lượng, sự hình thành liên kết …... năng lượng.
Cụm từ tích hợp điền vào chỗ chấm trên lần lượt là
A. cung cấp, giải phóng;
B. giải phóng, cung cấp;
C. cung cấp, cung cấp;
D. giải phóng, giải phóng.
Câu 2. Cho phản ứng có dạng: aA (g) + bB (g) ⟶ mM (g) + nN (g)
Công thức tính biến thiên enthalpy phản ứng theo năng lượng liên kết Eb là
A. =
B. =
C. =
D. =
Câu 3. Số lượng mỗi loại liên kết trong phân tử CH3Cl là
A. 1 liên kết C – H, 1 liên kết C – Cl;
B. 3 liên kết C – H, 1 liên kết H – Cl;
C. 2 liên kết C – H, 1 liên kết C – Cl;
D. 3 liên kết C – H, 1 liên kết C – Cl.
Câu 4. Cho phản ứng sau ở điều kiện chuẩn:
2H2 (g) + O2 (g) 2H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
A. – 506 kJ;
B. 428 kJ;
C. − 463 kJ;
D. 506 kJ.
Câu 5. Cho phản ứng:
4HCl (g) + O2 (g) 2Cl2 (g) + 2 H2O (g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là bao nhiêu? Phản ứng tỏa nhiệt hay thu nhiệt?
A. = − 148 kJ, phản ứng tỏa nhiệt;
B. = − 148 kJ, phản ứng thu nhiệt;
C. = 215 kJ, phản ứng tỏa nhiệt;
D. = 215 kJ, phản ứng thu nhiệt.
Câu 6. Cho phản ứng:
3O2 (g)⟶2O3 (g)(1)
2O3 (g) ⟶ 3O2 (g)(2)
Biết phân tử O3 gồm 1 liên kết đôi O = O và 1 liên kết đơn O – O.
So sánh của hai phản ứng là
A. (1) > (2);
B. (1) = (2);
C. (1) < (2);
D. (1) ≤ (2).
Câu 7. Cho phản ứng có dạng: aA + bB ⟶ mM + nN
Công thức tính biến thiên enthalpy phản ứng theo enthalpy tạo thành là
A. =
B. =
C. =
D. =
Câu 8. Cho phản ứng: NH3 (g) + HCl (g) ⟶ NH4Cl (s)
Biết = − 314,4 kJ/mol; = − 92,31 kJ/mol; = − 45,9 kJ/mol.
Biến thiên enthalpy chuẩn của phản ứng tính là
A. – 176,19 kJ;
B. – 314,4 kJ;
C. – 452,61 kJ;
D. 176,2 kJ;
Câu 9. Tính của phản ứng đốt cháy 1 mol C2H2 (g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
Chất |
C2H2 (g) |
CO2 (g) |
H2O (g) |
(kJ/mol) |
+ 227 |
− 393,5 |
− 241,82 |
A. – 1270,6 kJ
B. − 1255,82 kJ
C. – 1218,82 kJ
D. – 1522,82 kJ
Câu 10. Tính của phản ứng đốt cháy 21 gam CO (g) biết các sản phẩm thu được đều ở thể khí.
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
Chất |
CO (g) |
CO2 (g) |
O2 (g) |
(kJ/mol) |
- 110,5 |
− 393,5 |
0 |
A. – 59,43 kJ;
B. – 283 kJ;
C. − 212,25 kJ;
D. – 3962 kJ.
Câu 11. Tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm và cho biết đây là phản ứng tỏa nhiệt hay thu nhiệt.
2Al (s) + Fe2O3 (s) 2Fe (s) + Al2O3 (s)
Biết của Fe2O3 (s) và Al2O3 (s) lần lượt là -825,5 kJ/mol; -1676 kJ/mol
A. = − 850,5 kJ, phản ứng tỏa nhiệt;
B. = − 850,5 kJ, phản ứng thu nhiệt;
C. = − 2501,5 kJ, phản ứng tỏa nhiệt;
D. = − 2501,5 kJ, phản ứng thu nhiệt.
Câu 12. Để tính biến thiên enthalpy phản ứng theo năng lượng liên kết, phải viết được
A. công thức phân tử của tất cả các chất trong phản ứng
B. công thức cấu tạo của tất cả các chất trong phản ứng
C. công thức đơn giản nhất của tất cả các chất trong phản ứng
D. Cả A, B và C đều sai
Câu 13. Tính lượng nhiệt sinh ra khi đốt cháy hoàn toàn 7,8 gam C6H6 (l)
Cho enthalpy tạo thành chuẩn của các chất tương ứng là
Chất |
C6H6 (l) |
CO2 (g) |
H2O (g) |
(kJ/mol) |
+49 |
− 393,5 |
-241,82 |
A. 3135,46 kJ;
B. 684,32 kJ;
C. 313,546 kJ;
D. 68,432 kJ.
Câu 14. Cho phương trình nhiệt hóa học sau:
SO2 (g) + O2 (g) SO3 (g) = − 98,5 kJ
Lượng nhiệt giải phóng ra khi chuyển 76,8 gam SO2 (g) thành SO3 (g) là
A. 98,5 kJ;
B. 118,2 kJ;
C. 82,08 kJ;
D. 7564,8 kJ.
Câu 15. Cho phương trình nhiệt hóa học sau:
2H2 (g) + O2 (g) ⟶ 2H2O (g) = − 483,64 kJ
So sánh đúng là
A. (cđ) >(sp);
B. (cđ) = (sp);
C. (cđ) <(sp);
D. (cđ) ≤ (sp).
PHẦN II. TRẮC NGHIỆM ĐÚNG – SAI
Câu hỏi. Khi các phản ứng hóa học xảy ra thường có sự trao đổi nhiệt với môi trường, làm thay đổi nhiệt độ của môi trường.
a. Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
b. Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
c. Khi than, củi cháy không khí xung quanh ấm hơn do phản ứng tỏa nhiệt.
d. Pha viên C sủi vitamin C vào nước, khi viên C sủi tan thấy cốc nước mát hơn là do phản ứng thu nhiệt.
PHẦN III. TRẮC NGHIỆM TRẢ LỜI NGẮN
Câu 1. Dựa vào phương trình nhiệt hóa học của các phản ứng sau:
(1) CS2(l) + 3O2(g) CO2(g) + 2SO2(g);
(2) CO2(g) CO(g) + ½ O2(g);
(3) 2Na(s) + 2H2O(l) 2NaOH(aq) + H2(g);
(4) ZnSO4(s) ZnO(s) + SO2(g);
(5) 2SO2(g) + O2(g) 2SO3(g);
Liệt kê các phản ứng thu nhiệt theo số thứ tự tăng dần (ví dụ: 123, 25,...).
Câu 2. Phân tử hemoglobin(Hb) trong máu nhận O2 ở phổi để chuyển thành HbO2. Chất này theo máu tới các bộ phận cơ thể, tại đó HbO2 lại chuyển thành Hb và O2( để cung cấp O2 cho các hoạt động sinh hóa cần thiết trong cơ thể). Nếu trong không khí có lẫn carbon monoxide(CO), cơ thể nhanh chóng bị ngộ độc. Cho các số liệu thực nghiệm sau:
(1) Hb + O2 HbO2;
(2) Hb + CO НbСО;
(3) HbO2 + CO HbCO + O2;
(4) HbCO + O2 HbO2 + CO;
Liệt kê các phản ứng tỏa nhiệt theo số thứ tự tăng dần (ví dụ: 134, 24,...).
Xem thêm bài tập trắc nghiệm Hóa học lớp 10 Chân trời sáng tạo có đáp án hay khác:
Trắc nghiệm Hóa học 10 Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học
Trắc nghiệm Hóa học 10 Bài 15: Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng
Trắc nghiệm Hóa học 10 Bài 16: Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học
Trắc nghiệm Hóa học 10 Bài 17: Tính chất vật lí và hóa học các đơn chất nhóm VIIA
Trắc nghiệm Hóa học 10 Bài 18: Hydrogen halide và một số phản ứng của ion halide
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Chân trời sáng tạo
- Giải Chuyên đề Hóa học 10 Chân trời sáng tạo
- Giải SBT Hóa học 10 Chân trời sáng tạo
- Giải lớp 10 Chân trời sáng tạo (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Cánh diều (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST

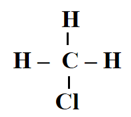



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

