Tính chất của amonia (NH3), muối Amoni (Tính chất hóa học, vật lí, Điều chế, Ứng dụng)
Bài viết Tính chất của amonia (NH3), muối Amoni gồm tính chất hóa học, tính chất vật lí, điều chế, ứng dụng hay, chi tiết giúp bạn nắm vứng kiến thức trọng tâm về amonia (NH3), muối Amoni.
Tính chất của amonia (NH3), muối Amoni (Tính chất hóa học, vật lí, Điều chế, Ứng dụng)
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Bài giảng: Bài 8 : amonia và muối amoni - Cô Nguyễn Nhàn (Giáo viên VietJack)
A. amonia
I. Cấu tạo phân tử
Trong phân tử NH3, N liên kết với ba nguyên tử hidro bằng ba liên kết cộng hóa trị có cực. NH3 có cấu tạo hình chóp với nguyên tử Nitơ ở đỉnh. Nitơ còn một cặp electron hóa trị là nguyên nhân tính bazơ của NH3.
II. Tính chất vật lý
- amonia (NH3) là chất khí không màu, có mùi khai xốc, nhẹ hơn không khí, tan rất nhiều trong nước.
III. Tính chất hóa học
1. Tính bazơ yếu
- Tác dụng với nước:
NH3 + H2O ⇋ NH4+ + OH-
⇒ Dung dịch NH3 là một dung dịch bazơ yếu.
- Tác dụng với dung dịch muối (muối của những kim loại có hidroxit không tan):
AlCl3 + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4Cl
Al3+ + 3NH3 + 3H2O → Al(OH)3↓ + 3NH4+
- Tác dụng với axit → muối amoni:
NH3 + HCl → NH4Cl (ammonium chloride)
2NH3 + H2SO4 → (NH4)2SO4 (amoni sunfat)
2. Khả năng tạo phức
Dung dịch amonia có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại, tạo thành các dung dịch phức chất.
Ví dụ:
* Với Cu(OH)2:
Cu(OH)2 + 4NH3 → [Cu(NH3)4](OH)2 (màu xanh thẫm)
* Với AgCl:
AgCl + 2NH3 → [Ag(NH3)2]Cl
Sự tạo thành các ion phức là do sự kết hợp các phân tử NH3 bằng các electron chưa sử dụng của nguyên tử nitơ với ion kim loại.
3. Tính khử
- amonia có tính khử: phản ứng được với oxi, clo và khử một số oxit kim loại (Nitơ có số oxi hóa từ -3 đến 0, +2).
- Tác dụng với oxi:
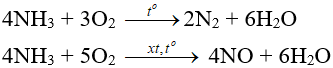
- Tác dụng với clo:
2NH3 + 3Cl2 → N2 + 6HCl
NH3 kết hợp ngay với HCl vừa sinh ra tạo “khói trắng” NH4Cl
- Tác dụng với CuO:
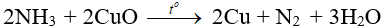
IV. Ứng dụng
- Sản xuất nitric acid, các loại phân đạm như ure (NH2)2CO; NH4NO3; (NH4)2SO4; …
- Điều chế hidrazin (N2H4) làm nhiên liệu cho tên lửa.
- Amoni lỏng dùng làm chất gây lạnh trong máy lạnh.
V. Điều chế
1. Trong phòng thí nghiệm
Đun nóng muối amoni với Ca(OH)2
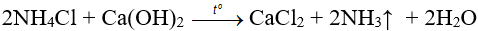
2. Trong công nghiệp
Tổng hợp từ nitơ và hiđro
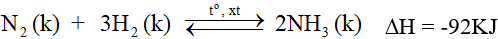
- Nhiệt độ: 450 – 500oC.
- Áp suất cao từ 200 – 300 atm.
- Chất xúc tác: sắt kim loại được trộn thêm Al2O3, K2O, ...
Làm lạnh hỗn hợp khí bay ra, NH3 hóa lỏng được tách riêng.
B. MUỐI AMONI
Là tinh thể ion gồm cation NH4+ và anion gốc axit.
I. Tính chất vật lý
- Là những hợp chất tinh thể ion, phân tử gồm cation NH4+ và anion gốc axit.
- Tan nhiều trong nước điện ly hoàn toàn thành các ion.
NH4Cl → NH4+ + Cl-; Ion NH4+ không có màu.
II. Tính chất hóa học
1.Phản ứng thuỷ phân: Tạo môi trường có tính axit làm quỳ tím hoá đỏ.
NH4+ + HOH → NH3 + H3O+ (Tính axit)
2. Tác dụng với dung dịch kiềm: (nhận biết ion amoni, điều chế amonia trong phòng thí nghiệm)
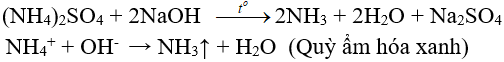
3. Phản ứng nhiệt phân
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
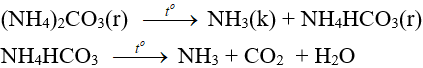
NH4HCO3 (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa khi bị nhiệt phân cho ra N2, N2O.
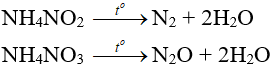
- Nhiệt độ lên tới 500oC, ta có phản ứng:
2NH4NO3 → 2N2 + O2 + 4H2O
Thi online Hóa 11 KNTTThi online Hóa 11 CDThi online Hóa 11 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 11 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Khái quát Nhóm Nitơ
- Lý thuyết Nitơ
- Lý thuyết nitric acid và muối nitrate
- Lý thuyết Photpho
- Lý thuyết phosphoric acid và muối Photphat
- Lý thuyết Phân bón hóa học
- Lý thuyết Tính chất của Nitơ và hợp chất của chúng
- Lý thuyết Tính chất của Photpho và hợp chất của chúng
- Dạng 1: Bài tập về tính chất hóa học và phương pháp điều chế N2, NH3, HNO3, muối nitrate
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 11 Global Success
- Giải sgk Tiếng Anh 11 Smart World
- Giải sgk Tiếng Anh 11 Friends Global
- Lớp 11 - Kết nối tri thức
- Soạn văn 11 (hay nhất) - KNTT
- Soạn văn 11 (ngắn nhất) - KNTT
- Giải sgk Toán 11 - KNTT
- Giải sgk Vật Lí 11 - KNTT
- Giải sgk Hóa học 11 - KNTT
- Giải sgk Sinh học 11 - KNTT
- Giải sgk Lịch Sử 11 - KNTT
- Giải sgk Địa Lí 11 - KNTT
- Giải sgk Giáo dục KTPL 11 - KNTT
- Giải sgk Tin học 11 - KNTT
- Giải sgk Công nghệ 11 - KNTT
- Giải sgk Hoạt động trải nghiệm 11 - KNTT
- Giải sgk Giáo dục quốc phòng 11 - KNTT
- Giải sgk Âm nhạc 11 - KNTT
- Lớp 11 - Chân trời sáng tạo
- Soạn văn 11 (hay nhất) - CTST
- Soạn văn 11 (ngắn nhất) - CTST
- Giải sgk Toán 11 - CTST
- Giải sgk Vật Lí 11 - CTST
- Giải sgk Hóa học 11 - CTST
- Giải sgk Sinh học 11 - CTST
- Giải sgk Lịch Sử 11 - CTST
- Giải sgk Địa Lí 11 - CTST
- Giải sgk Giáo dục KTPL 11 - CTST
- Giải sgk Hoạt động trải nghiệm 11 - CTST
- Giải sgk Âm nhạc 11 - CTST
- Lớp 11 - Cánh diều
- Soạn văn 11 Cánh diều (hay nhất)
- Soạn văn 11 Cánh diều (ngắn nhất)
- Giải sgk Toán 11 - Cánh diều
- Giải sgk Vật Lí 11 - Cánh diều
- Giải sgk Hóa học 11 - Cánh diều
- Giải sgk Sinh học 11 - Cánh diều
- Giải sgk Lịch Sử 11 - Cánh diều
- Giải sgk Địa Lí 11 - Cánh diều
- Giải sgk Giáo dục KTPL 11 - Cánh diều
- Giải sgk Tin học 11 - Cánh diều
- Giải sgk Công nghệ 11 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 11 - Cánh diều
- Giải sgk Giáo dục quốc phòng 11 - Cánh diều
- Giải sgk Âm nhạc 11 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

