100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải (nâng cao – phần 3)
Với 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm.
100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải (nâng cao – phần 3)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập trọng tâm về kim loại kiềm, kim loại kiềm thổ và nhôm - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Câu 71. Nhỏ từ từ từng giọt đến hết 30ml dung dịch HCl 1M vào 100ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,030. B. 0,010.
C. 0,020. D. 0,015.
Lời giải:
Theo thứ tự phản ứng HCl sẽ phản ứng với Na2CO3 trước, lượng dư mới phản ứng với NaHCO3.
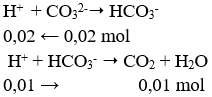
→ Đáp án B
Câu 72. Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1 : 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
A. 10,8 B. 5,4
C. 7,8 D. 43,2
Lời giải:
Ta có: nH2 = 0,896/22,4 = 0,04 mol
Gọi: nNa = x mol → nAl = 2x mol
Phản ứng:
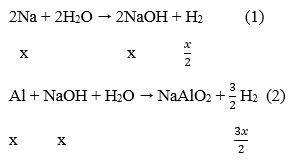
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2) ∑nH2 = x/2 + 3x/2 = 0,4 → x = 0,2 mol
mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol → nAl dư = 0,4 - 0,2 = 0,2 mol
mAl = 0,2.27 = 5,4 (g)
→ Đáp án B
Câu 73. Hỗn hợp X gồm Na, Al và Fe (với tỉ lệ số mol giữa Na và Al tương ứng là (2 : 1). Cho X tác dụng với H2O (dư) thu được chất rắn Y và V lít khí. Cho toàn bộ Y tác dụng với dung dịch H2SO4 loãng (dư) thu được 0,25V lít khí. Biết các khí đo ở cùng điều kiện, các phản ứng đều xảy ra hoàn toàn. Tỉ lệ số mol của Fe và Al trong X tương ứng là
A. 1 : 2. B. 5 : 8.
C. 5 : 16. D. 16 : 5.
Lời giải:
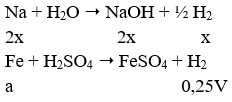
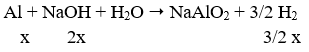
Ta có: a = 0,25V;
còn: x + 3x/2 = 5x/2 = 2,5x = V suy ra x = V/2,5
Vậy a/x = 0,25V/0,4V = 5/8
→ Đáp án B
Câu 74. Thuốc thử dùng để nhận biết các dung dịch NaCl, CaCl2, MgCl2 là:
A. NaOH, HCl B. Quì tím, NaOH
C. NaOH, Na2CO3 D. Quì tím, HCl.
Lời giải:
- Cho NaOH lần lượt vào các mẫu thử. Có kết tủa trắng là MgCl2
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
- Tiếp tục cho Na2CO3 vào 2 mẫu thử còn lại ⇒ Xuất hiện tủa trắng là CaCl2
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
→ Đáp án C
Câu 75. Hòa tan hoàn toàn 8,9 gam hỗn hợp gồm Mg và Zn bằng lượng vừa đủ 500 ml dung dịch HNO3 1M. Sau khi các phản ứng kết thúc, thu được 1,008 lít khí N2O (đktc) duy nhất và dung dịch X chứa m gam muối. Giá trị của m là
A. 34,10 B. 31,32
C. 34,32 D. 33,70
Lời giải:
Số mol N2O = 1,008/22,4 = 0,045 mol;
4M + 10HNO3 (0,5) → 4M(NO3)2 + N2O (0,045) + 5H2O
Số mol HNO3 phản ứng = 0,045.10 = 0,45 mol < 0,5 suy ra có tạo sản phẩm khử khác là NH4NO3
4M + 10HNO3 (0,05) → 4M(NO3)2 + NH4NO3 (0,005) + 3H2O
Vậy m = 8,9 + 62.( 8.0,045 + 8.0,005)+ 80.0.005=34,1g
→ Đáp án A
Câu 76. Trộn 0,25 mol bột Al với 0,15 mol bột Fe2O3 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí (giả sử chỉ có phản ứng khử Fe2O3 về Fe) thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, m gam chất rắn khan Z và 0,15 mol H2. Hiệu suất phản ứng nhiệt nhôm và giá trị của m lần lượt là
A. 60% và 20,40
B. 60% và 30,75
C. 50% và 20,75
D. 50% và 40,80
Lời giải:
nAl dư = 2nH2/3 = 0,1 mol
⇒ H = [(0,25 – 0,1)/0,25]. 100% = 60%
2Al (0,15) + Fe2O3 → Al2O3 +2Fe
⇒ mZ = 160.(0,15 – 0,075) + 56.0,15 = 20,4 g
→ Đáp án A
Câu 77. Dung dịch X chứa 0,12 mol Na+; x mol SO42-; 0,12 mol Cl- và 0,05 mol NH4+. Cho 300 ml dung dịch Ba(OH)2 0,1M vào X đến khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa, thu được dung dịch Y. Cô cạn Y, thu được m gam chất rắn khan. Giá trị của m là
A. 7,190 B. 7,020
C. 7,875 D. 7,705.
Lời giải:
Có dung dịch X gồm NaCl (0,12 mol), và (NH4)2SO4 (0,025 mol)
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3 + 2H2O
Sau phản ứng dư: 0,005 mol Ba(OH)2 trong dung dịch
m = 0,12.58,5 + 0,005.171 = 7,875 gam
→ Đáp án C
Câu 78. Hòa tan hoàn toàn 3,60 gam Mg trong 500 ml dung dịch HNO3 0,80M, phản ứng kết thúc thu được 448 ml một khí X (ở đktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2M. Giá trị của V là:
A. 167,5. B. 230.
C. 156,25. D. 173,75.
Lời giải:
Bảo toàn khối lượng: mdung dịch tăng = mMg – mX ⇒ mX = 3,6 – 3,04 = 0,56(g).
⇒ MX = 0,56 : 0,02 = 28 (N2)
Chú ý: "hòa tan hoàn toàn" ⇒ Mg hết.
Bảo toàn electron: 2nMg = 10nN2 + 8nNH4NO3 ⇒ nNH4NO3 = 0,0125 mol.
Bảo toàn nguyên tố Nitơ: ∑nNO3-/Y = 0,4 – 0,02 x 2 – 0,0125 = 0,3475 mol.
⇒ Bảo toàn nguyên tố Natri: nNaOH = nNaNO3 = 0,3475 mol ⇒ V = 173,75 ml
→ Đáp án D
Câu 79. Cho 8,96 lít CO2 (đktc) sục vào dung dịch chứa 100 ml dung dịch chứa hỗn hợp Ca(OH)2 2M và NaOH 1,5M thu được a gam kết tủa và dung dịch X. Đun nóng kĩ dung dịch X thu được thêm b gam kết tủa. Giá trị (a + b) là
A. 5 gam B. 15 gam
C. 20gam D. 40gam
Lời giải:
Có
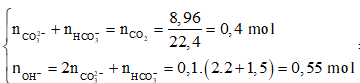
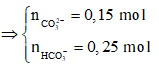
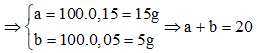
→ Đáp án C
Câu 80. Nung nóng m gam hỗn hợp gồm Al và Fe3O4 trong điều kiện không có không khí. Sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng với dung dịch NaOH (dư) thu được dung dịch Y, chất rắn Z và 3,36 lít khí H2 (ở đktc). Sục khí CO2 (dư) vào dung dịch Y, thu được 39 gam kết tủa. Giá trị của m là:
A. 45,6 gam B. 57,0 gam
C. 48,3 gam D. 36,7 gam
Lời giải:
nH2 = 0,15 mol ; nAl(OH)3 = 0,5 mol
- Hỗn hợp rắn X gồm: Fe, Al2O3 (x mol) và Al dư (y mol)
Phương trình hóa học:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
CO2 + Na[Al(OH)4] → Al(OH)3 + NaHCO3
nH2 = 0,15 mol → y = 0,1 mol
Áp dụng ĐLBT nguyên tố với Al: 2x + y = 0,5 → x = 0,2 mol
Áp dụng ĐLBT nguyên tố với O: nO(Fe3O4) = nO(Al2O3) = 0,2. 3 = 0,6 mol
→ nFe3O4 = 0,15 mol
Áp dụng nguyên tố với Fe: nFe = 3nFe3O4 = 3. 0,15 = 0,45 mol
Áp dụng khối lượng: m = 0,45.56 + 0,2.102 + 0,1.27 = 48,3 gam
→ Đáp án C
Câu 81. Hỗn hợp X gồm Fe2O3 và Al có tỉ lệ mol tương ứng là 1:3. Thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
A. Al2O3 và Fe
B. Al, Fe và Al2O3
C. Al, Fe, Fe3O4 và Al2O3
D. Al2O3 , Fe và Fe3O4
Lời giải:
8Al + 3Fe3O4 -to→ 4Al2O3↓ + 9Fe
⇒ nFe3O4 / nAl = 3/8 < 1/3 ⇒ Al còn Fe3O4 hết
⇒ Hỗn hợp sản phẩm gồm Al2O3, Fe và Al
→ Đáp án B
Câu 82. Đốt cháy hoàn toàn m gam FeS2 bằng một lượng O2 vừa đủ, thu được khí X. Hấp thụ hết X vào 1 lít dung dịch chứa Ba(OH)2 0,15M và KOH 0,1M, thu được dung dịch Y và 21,7 gam kết tủa. Cho Y vào dung dịch NaOH, thấy xuất hiện thêm kết tủa. Giá trị của m là:
A. 23,2 B. 12,6
C. 18,0 D. 24,0
Lời giải:
Pt pư: 4FeS2 (0,15) + 11O2 -to→ 2Fe2O3 (0,3) + 8SO2 (1)
Ta có: nBa(OH)2 = 0,15 mol
nKOH = 0,1 mol => nBa2+ = 0,15 mol; nOH- = 0,4 mol
Khi cho SO2 vào dung dịch Y thu được 21,7 (g) ↓ BaSO3. Cho Y tác dụng với dung dịch NaOH thấy xuất hiện thêm kết tủa, chứng tỏ trong dung dịch Y có ion HSO3-.
Vì: Ba2+ + HSO3- + OH- → BaSO3↓ + H2O
Ta có: nBaCO3 = 0,1 mol
Phương trình hóa học:

Ta có: nOH- = 0,4 - 0,2 = 0,2 mol
Theo ptpư (2), (3) ta có: nSO2 = 0,1 + 0,2 = 0,3 mol
Theo ptpư (1) ta có: nFeS2 = 1/2 nSO2 = 0,15 mol ⇒ mFeS2 = 120.0,15 = 15 (g)
→ Đáp án C
Câu 83. Cho dung dịch Ba(HCO3)2 lần lượt vào các dung dịch: CaCl2, Ca(NO3)2, NaOH, Na2CO3, KHSO4, Na2SO4, Ca(OH)2, H2SO4, HCl. Số trường hợp có tạo ra kết tủa là:
A. 4 B. 7
C. 5 D. 6
Lời giải:
Các phản ứng tạo kết tủa:
Ba(HCO3)2 + 2NaOH → BaCO3 ↓ + Na2CO3 + H2O
Ba(HCO3)2 + Na2CO3 → BaCO3 ↓ + 2NaHCO3
Ba(HCO3)2 + 2KHSO4 → BaSO4 ↓ + K2SO4 + 2CO2 + 2H2O
Ba(HCO3)2 + Na2SO4 → BaSO4 ↓ + 2NaHCO3
Ba(HCO3)2 + Ca(OH)2 → BaCO3 ↓ + CaCO3 ↓ + 2H2O
Ba(HCO3)2 + H2SO4 → BaSO4 ↓ + 2CO2 + 2H2O
→ Đáp án D
Câu 84. Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
A. 2,44 gam B. 2,22 gam
C. 2,31 gam D. 2,58 gam.
Lời giải:
Ta có: số mol CO2 = 0,015 mol;
Số mol OH- = 0,02 + 0,02 = 0,4 mol;
Vậy k > 2 nên tạo muối trung hòa, dư OH-:
khối lượng rắn = 23.0,02 + 39.0,02 + 0,015.60 + 0,01.17 = 2,31g
→ Đáp án C
Câu 85. Nung hỗn hợp gồm 10,8 gam gam Al và 16,0 gam Fe2O3 (trong điều kiện không có không khí), sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Khối lượng kim loại M trong Y là:
A. 5,6 gam B. 22,4 gam
C. 11,2 gam D. 16,6 gam
Lời giải:
2Al (0,2) + Fe2O3 (0,1) → Al2O3 + 2Fe (0,2)
⇒ Khối lượng kim loại trong Y = mFe + mAl dư = 56.0,2 + 10,8 - 27.0,2 = 16,6 g
→ Đáp án D
Câu 86. Cho hỗn hợp K2CO3 và NaHCO3 (tỉ lệ mol 1 : 1) vào bình dung dịch Ba(HCO3)2 thu được kết tủa X và dung dịch Y. Thêm từ từ dung dịch HCl 0,5M vào bình đến khi không còn khí thoát ra thì hết 560 ml. Biết toàn bộ Y phản ứng vừa đủ với 200 ml dung dịch NaOH 1M. Khối lượng kết tủa X là
A. 3,94 gam. B. 7,88 gam.
C. 11,28 gam. D. 9,85 gam.
Lời giải:
Dung dịch Y có HCO3- phản ứng NaOH tỉ lệ mol 1:1 nên nHCO3- trong Y= 0,2 mol
Gọi số mol K2CO3 là x và Ba(HCO3)2 là y.
Khi phản ứng HCl ta có số mol HCl = 2x + x + 2y = 0,28 hay 3x + 2y = 0,28;
nHCO3- = x + 2y = 0,2 nên x = 0,04 và y = 0,08.
Vậy nBaCO3 = x = 0,04 ⇒ m = 7,88g
→ Đáp án B
Câu 87. Hòa tan hoàn toàn 13,44 gam kim loại M bằng dung dịch HCl, thu được 5,376 lít khí H2 (đktc). Kim loại M là
A. Mg. B. Al.
C. Zn. D. Fe.
Lời giải:
Đặt n là hóa trị của M. Bảo toàn electron: n x nM = 2nH2.
⇒ nM = 0,48/n ⇒ MM = 13,44/(0,48:n) = 28n.
⇒ n = 2 và MM = 56 (Fe)
→ Đáp án D
Câu 88. Cho dãy các kim loại: Fe, Zn, Al, Mg, Ag, Cu. Số lượng kim loại vừa phản ứng được với dung dịch NaHSO4, vừa phản ứng được với dung dịch HNO3 đặc, nguội là
A. 3. B. 4.
C. 2. D. 5.
Lời giải:
NaHSO4 có tính axit mạnh (điện li hoàn toàn ra H+).
NaHSO4 → Na+ + H+ + SO42–.
Al, Fe và Cr bị thụ động với HNO3 đặc, nguội.
⇒ Các kim loại thỏa mãn điều kiện trên là Zn và Mg
→ Đáp án C
Lời giải:
→ Đáp án
Câu 89. Hỗn hợp X gồm Na, Al và Fe, hỗn hợp Y gồm Al và kim loại R. Biết rằng, khối lượng của Al có trong X và Y bằng nhau, tổng khối lượng của Na và Fe có trong X gấp 2 lần khối lượng của R có trong Y. Hòa tan hoàn toàn lần lượt X, Y băng lượng dư dung dịch H2SO4 loãng thì cả 2 trường hợp đều thu được V lít khí H2 (đktc). Kim loại R là
A. Ca. B. Be.
C. Zn. D. Mg.
Lời giải:
Do lượng Al trong X và Y như nhau ⇒ khác nhau là do Na, Fe và R
⇒ Bỏ Al ra để tiện xét bài toán ⇒ Xét hỗn hợp X gồm Na, Fe và Y chỉ chứa R.
Giả sử mY = 100g ⇒ ∑mX = 200g.
• Giả sử hỗn hợp X chỉ chứa Na ⇒ nNa = 200 : 23 mol ⇒ nH2 = 100/23 mol.
• Giả sử hỗn hợp X chỉ chứa Fe ⇒ nH2 = nFe = 200 : 56 mol = 25/7 mol.
Thực tế X chứa cả Na và Fe ⇒ 25/7 < nH2 < 100/23 mol.
Gọi hóa trị của R là n. Bảo toàn electron: nR = 2nH2/n.
⇒ 50 / 7n < nR < 200 / 23n ⇒ 11,5n < MR = 100/nR < 14n.
TH1: n = 1 ⇒ 11,5 < MR < 14 ⇒ không có kim loại nào.
TH2: n = 2 ⇒ 23 < MR < 28 ⇒ R là Magie(Mg) ⇒ chọn D.
TH3: n = 3 ⇒ 34,5 < MR < 42 ⇒ không có kim loại nào.
→ Đáp án D
Câu 90. Cho 7,2 gam bột Mg tan hết trong dd hỗn hợp HCl (dư) và KNO3 thu được dung dịch X chứa m gam muối và 2,688 lít khí Y (đktc) gồm N2 và H2 có khối lượng 0,76 gam. Giá trị của m là
A. 28,50. B. 30,5.
C. 34,68. D. 29,84.
Lời giải:
Từ nHỗn hợp 2 khí và khối lượng 2 khí ⇒ nN2 = 0,01 và nH2 = 0,1 mol.
Bảo toàn e ta có nNH4+ =
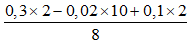
⇒ nHCl = 12nN2 + 2nH2 + 10nNH4+ = 0,69 mol.
Sơ đồ bài toán:
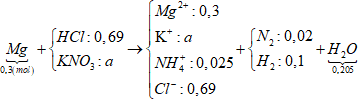
+ Bảo toàn điện tích hoặc bảo toàn nitơ ⇒ nK+ = 0,065 mol.
⇒ mMuối = 0,3x24 + 0,065x39 + 0,025x18 + 0,69x35,5 = 34,68 gam.
→ Đáp án C
Câu 91. Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là:
A. 10,4 B. 27,3
C. 54,6 D. 23,4
Lời giải:
- Theo đề ta có :
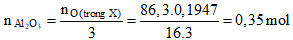
- Khi hòa tan hỗn hợp X bằng nước. Xét dung dịch Y ta có:
+ nAlO2 = 2nAl2O3 = 0,7 mol -BTDT→ nOH- = 2nH2 - 2nAlO2- = 0,5 mol
- Khi cho dung dịch Y tác dụng với 2,4 mol HCl, vì:
nAlO2- + nOH- < nH+ < 4nAlO2- + nOH-
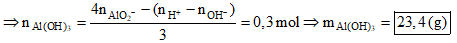
→ Đáp án D
Câu 92. Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3-, a mol OH-, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X nói trên là
A. 1,68 gam. B. 2,56 gam.
C. 3,36 gam. D. 3,42 gam.
Lời giải:
Số mol nHCl = 0,04 mol ⇒ nOH- = 0,04 mo.
⇒ Bảo toàn điện tích ta có: nNa+ = 0,03 mol.
⇒ Chất rắn thu được khi cô cạn dd X = 0,01 x 137 + 0,01 x 62 + 0,04 x 17 + 0,03 x 23 = 3,36 gam.
→ Đáp án C
Câu 93. Cho 200 ml dung dịch Ba(OH)2 0,1M vào 300 ml dung dịch NaHCO3 0,1M, thu được dung dịch X và kết tủa Y. Cho từ từ dung dịch HCl 0,25M vào X đến khi bắt đầu có khí sinh ra thì hết V ml. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của V là
A. 80 B.160
C.60 D. 40
Lời giải:
Có nCO32- = nHCO3- = 0,03 mol > nBa2+ = 0,02 mol (có 0,02 mol BaCO3)
⇒ dung dịch X có 0,01 mol CO32-
Và nOH- dư = 0,04 – 0,03 = 0,01 mol,
Để vừa bắt đầu xuất hiện bọt khí thì
nH+ = nOH- + nCO32- = 0,01 + 0,01 = 0,02 =0,25V
⇒ V = 80 ml
→ Đáp án A
Câu 94. Trộn 10,8 g bột Al với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hòa tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 10,752 lít khí H2 (đktc). Hiệu suất của phản ứng nhiêt nhôm là
A. 80% B. 90%
C. 70% D. 60%
Lời giải:
Ta có: nAl = 10,8/27 = 0,4 mol;
nFe3O4 = 34,8/232 = 0,15 mol; nH2 = 10,752/22,4 = 0,48 mol
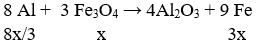
Gọi số mol Fe3O4 phản ứng là x mol
Vì hiệu suất không đạt 100% nên cả Al và Fe3O4 đều chưa phản ứng hết.
⇒ hỗn hợp chất rắn Al dư, Fe3O4 dư , Al2O3 và Fe.
Theo phản ứng:
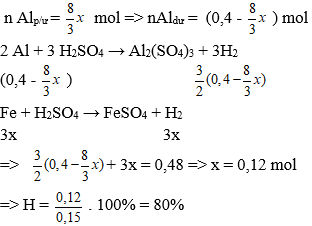
→ Đáp án A
Câu 95. Hỗn hợp X chứa Al và Na có khối lượng a gam. Cho hỗn hợp X vào lượng nước dư, thấy thoát ra 4,48 lít khí H2. Nếu cho hỗn hợp X vào lượng KOH dư, thấy thoát ra 7,84 lít khí H2. Các thể tích khí đo ở điều kiện chuẩn. Giá trị của a là
A. 7,7. B. 7,3.
C. 5,0. D. 6,55.
Lời giải:
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Phản ứng với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2x2 = 0,4 (1).
+ Phản ứng với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35x2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2 x 27 + 0,1 x 23 = 7,7 gam
→ Đáp án A
Câu 96. Hấp thụ hoàn toàn 0,672 lit khí CO2 (đktc) vào 1 lít dd gồm NaOH 0,025M và Ca(OH)2 0,0125M, thu được x gam kết tủa. Giá trị của x là :
A. 2,00 B. 0,75
C. 1,25 D. 1,00
Lời giải:
nOH- = nNaOH + 2nCa(OH)2 = 0,05 mol
nCO2 = 0,672/22,4 = 0,03 mol
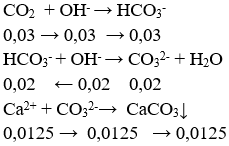
⇒ x = 0,0125.100 = 1,25 g
→ Đáp án C
Câu 97. Hỗn hợp X gồm hai kim loại kiềm và một kim loại kiềm thổ. Hòa tan hoàn toàn 1,788 gam X vào nước, thu được dung dịch Y và 537,6 ml khí H2 (đktc). Dung dịch Z gồm H2SO4 và HCl, trong đó số mol của HCl gấp hai lần số mol của H2SO4. Trung hòa dung dịch Y bằng dung dịch Z tạo ra m gam hỗn hợp muối. Giá trị của m là
A. 4,656 B. 4,460
C. 2,790 D. 3,792
Lời giải:
Có nH2SO4 = x mol; nHCl = 2x mol
4x = 0,024.2 ⇒ x = 0,012 mol
⇒ mmuối = 1,788 + 0,024.35,5 + 0,012.96 = 3,792 gam
→ Đáp án D
Câu 98. Cho các dung dịch đựng trong các lọ mất nhãn sau: NaCl, Na2CO3, Na2SO3, Na2S, HCl. Chỉ dùng một chất nào sau đây có thể nhận biết được cả 5 chất trên?
A. Quì tím B. H2SO4
C. Pb(NO3)2 D. BaCl2
Lời giải:
Thí nghiệm trên từng lượng nhỏ hóa chất
Cho quỳ tím vào từng dung dịch: HCl làm quì tím hóa đỏ, Na2CO3 làm quì tím hóa xanh.
Cho HCl vào 3 mẫu thử còn lai. Lọ có khí thoát ra có mùi trứng thối là Na2S, lọ có khí mùi sốc là Na2SO3, lọ còn lại không hiện tượng là NaCl.
Phương trình hóa học:
2HCl + Na2S → 2NaCl + H2S
2HCl + Na2SO3 → 2NaCl + SO2 + H2O.
→ Đáp án A
Câu 99. Hòa tan hỗn hợp gồm: K2O, BaO, Al2O3, Fe3O4 vào nước (dư) thu được dung dịch X và chất rắn Y. Sục khí CO2 đến dư vào dung dịch X, sau khi các phản ứng xảy ra hoàn toàn thu được kết tủa là:
A. K2CO3 B. Fe(OH)3
C. Al(OH)3 D. BaCO3
Lời giải:
Phương trình phản ứng:
K2O + H2O → 2KOH
BaO + 2H2O → Ba(OH)2
Al2O3 + OH- → 2AlO2- + H2O
⇒ Chất rắn Y: Fe3O4, dung dịch X chứa ion AlO2-
AlO2- + CO2 + H2O → Al(OH)3↓ + HCO3-
Chỉ dùng dung dịch KOH để phân biệt được các chất riêng biệt trong nhóm nào sau đây?
→ Đáp án C
Câu 100. Thuốc thử dùng để nhận biết Na, Ca, Na2O là:
A. H2O, quỳ tím
B. H2O, dung dịch Na2CO3
C. Dung dịch HCl, quì tím
D. H2O, dung dịch HCl.
Lời giải:
- Lần lượt hòa tan các mẫu thử vào nước: tan và có khí thoát ra là Na và Ca; mẫu tan nhưng không có khí là Na2O.
PTHH: Ca + 2H2O → Ca(OH)2 + H2
Na + H2O → NaOH + 3/2 H2
Na2O + H2O → 2NaOH
- Tiếp tục cho Na2CO3 vào dung dịch thu được từ 2 mẫu có khí thoát ra. Mẫu nào xuất hiện kết tủa là Ca(OH)2 ⇒ chất ban đầu là Ca.
Na2CO3 + Ca(OH)2 → CaCO3 + 2NaOH
→ Đáp án B
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải (cơ bản – phần 1)
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải (cơ bản – phần 2)
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải (cơ bản – phần 3)
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải (nâng cao – phần 1)
- 100 câu trắc nghiệm Kim loại kiềm, Kim loại kiềm thổ, Nhôm có lời giải (nâng cao – phần 2)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

