30 Bài tập glucose nâng cao (có lời giải)
Với 30 Bài tập glucose nâng cao có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm Bài tập glucose nâng cao
30 Bài tập glucose nâng cao (có lời giải)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập về phản ứng lên men tinh bột, glucose - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Bài 1: Chia 200 gam dung dịch hỗn hợp glucose và fructose thành hai phần bằng nhau:
• Phần 1: Tác dụng với dung dịch AgNO3 trong NH3 dư thu được 86,4 gam Ag kết tủa
• Phần 2: Phản ứng vừa hết với 28,8 gam Br2 trong dung dịch Nồng độ phần trăm của fructose trong dung dịch ban đầu là:
A. 39,6 % B. 16,2 %
C. 25,5 % D. 33,3 %
Lời giải:
Đáp án: A
Nhận thấy cho hỗn hợp glucose và fructose phản ứng với Br2 thì chỉ có glucose tham gia phản ứng
⇒ nBr2 = nglucose = 0,18 mol.
Khi tác dụng với AgNO3 trong NH3 dư thì cả glucose và fructose tham gia phản ứng
⇒ nfructose + nglucose = nAg:2 ⇒ nfructose = 0,8 : 2 - 0,18 = 0,22 mol.
C% fructose =
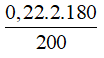
Bài 2: Đốt cháy hoàn toàn hỗn hợp X gồm glucôzơ, formic aldehyde, acetic acid cần 2,24 lít O2 (đo ở đktc). Dẫn sản phẩm cháy qua bình đựng dung dịch Ca(OH)2 dư, thấy khối lượng dd trong bình thay đổi:
A. Tăng 6,2g B. Tăng 3,8g
C. Giảm 3,8g D. Giảm 6,2g
Lời giải:
Đáp án: C
Khi đốt hỗn hợp X gồm glucôzơ, formic aldehyde, acetic acid ta có:
nO2 = nCO2 = nH2O = 0,1 mol
Khi cho sản phẩm vào bình đựng Ca(OH)2 dư: nCaCO3 = nCO2 = 0,1 mol
⇒ mCaCO3 = 10g
mCO2 + mH2O = 6,2g < m↓
⇒ mdung dịch giảm = mCaCO3 – (mCO2 + mH2O) = 3,8g
Bài 3: Đốt cháy hoàn toàn một hỗn hợp gồm methanal, axit etanoic, glucose và fructose cần 3,36 lít O2 (đktc). Dẫn sản phẩm cháy qua bình đựng dung dịch Ca(OH)2 dư, sau phản ứng thu được kết tủa và dung dịch X. Khối lượng dung dịch X so với khối lượng dung dịch Ca(OH)2 ban đầu đã thay đổi như thế nào ?
A. Giảm 5,7 gam B. Tăng 5,7 gam
C. Tăng 9,3 gam D. Giảm 15,0 gam
Lời giải:
Đáp án: A
Nhận thấy hỗn hợp methanal, axit etanoic, glucose và fructose đều có dạng CnH2nOn.
CnH2nOn + nO2 → nCO2 + nH2O
Ta có nO2 = nCO2 = nH2O = 0,15 mol.
Ta có mCO2 + mH2O - mCaCO3 = 0,15 × 44 + 0,15 × 18 - 0,15 × 100= -5,7.
⇒ Khối lượng dung dịch giảm 5,7g
Bài 4: Cho 50 ml dung dịch X chứa 3,51 gam hỗn hợp saccharose và glucose phản ứng với lượng dư AgNO3 trong dung dịch NH3, thu được 2,16 gam Ag. Đun nóng 100 ml dung dịch X với 100 ml dung dịch H2SO4 0,05M cho đến khi phản ứng hoàn toàn thu được dung dịch Y, giả thiết thể tích dung dịch không thay đổi. Nồng độ mol của glucose có trong dung dịch Y là ?
A. 0,10M B. 0,25M
C. 0,20M D. 0,15M
Lời giải:
Đáp án: D
nAg = 0,02 mol ⇒ nglucose = 0,01 mol
⇒ msaccharose =
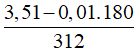
Trong 100g dung dịch X: nglucose = 0,02 mol; nsaccharose = 0,01 mol
Saccraozơ → glucose + fructose
⇒ nglucose = 0,02 + 0,01 = 0,03 mol
CM glucose =
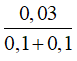
Bài 5: Hỗn hợp X gồm glucose và maltose. Chia X làm 2 phần bằng nhau:
- Phần 1: Hoà tan vào nước, lọc lấy dung dịch rồi cho tác dụng với AgNO3/NH3 dư được 0,02 mol Ag.
- Phần 2: Đun với dung dịch H2SO4 loãng. Hỗn hợp sau phản ứng được trung hoà bởi dung dịch NaOH, sau đó cho toàn bộ sản phẩm tác dụng với lượng dư dung dịch AgNO3/NH3 được 0,03 mol Ag. Số mol của glucose và maltose trong X lần lượt là
A. 0,01 và 0,01. B. 0,0075 và 0,0025.
C. 0,005 và 0,005. D. 0,0035 và 0,0035.
Lời giải:
Đáp án: A
nglucose = a mol, nmaltose = b mol.
- Phần 1: 1glucose → 2Ag, 1maltose → 2Ag
nAg = 2 × nglucose + 2 × nmaltose = 2 × a/2 + 2 × b/2 = a + b = 0,02.
- Phần 2 : thủy phân maltose thu được nglucose'' = 2 × nmaltose = 2 × b/2 = b mol.
∑nglucose = nglucose'' + nglucose ban đầu = b + a/2 mol.
1glucose → 2Ag
nAg = 2 × nglucose = 2 × (b + a/2) = 0,03.
⇒ nglucose = 0,01 mol; nmaltose = 0,01 mol
Bài 6: Hỗn hợp X gồm glucose và tinh bột được chia thành hai phần bằng nhau. Phần thứ nhất được khuấy trong nước, lọc và cho nước lọc phản ứng với dung dịch AgNO3 dư/NH3 thấy tách ra 2,16 gam Ag. Phần thứ hai được đun nóng với dung dịch H2SO4 loãng, trung hòa hỗn hợp thu được bằng dung dịch NaOH rồi cho sản phẩm tác dụng với dung dịchAgNO3 (dư)/NH3 thấy tách ra 6,48 gam Ag. Giả sử các phản ứng xảy ra hoàn toàn. Hỗn hợp ban đầu có % khối lượng glucose và tinh bột lần lượt là
A. 35,29 và 64,71. B. 64,71 và 35,29.
C. 64,29 và 35,71. D. 35,71 và 64,29
Lời giải:
Đáp án: D
Gọi số mol trong mỗi phần là: nglucose = a mol; ntinh bột = b mol.
- Phần 1: 1glucose → 2Ag
nAg = 2 nglucose = 2a =
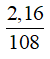
- Phần 2: (C6H10H5)n → nC6H12O6 ; nglucose sinh ra = bn mol
∼nglucose = nglucose sinh ra + nglucose ban đầu = bn +a
nAg = 2nglucose = 2 × (bn+a) =
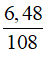
⇒ bn + a = 0,03 ⇒ bn = 0,03 – 0,01 = 0,02 mol
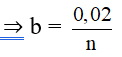
mglucose = 0,01.180 = 1,8 gam;
nCellulose =
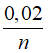
%mglucose =
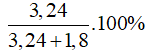
Bài 7: Đun m gam hỗn hợp X gồm saccharose và glucose (khối lượng saccharose gấp 2 lần khối lượng glucose) với dung dịch H2SO4 loãng, khi phản ứng kết thúc đem trung hòa, sau đó thực hiện phản ứng tráng bạc thu được 64,8 gam Ag. Giá trị của m là
A. 52,169. B. 56,095.
C. 90,615. D. 49,015.
Lời giải:
Đáp án: A
nsaccharose = a mol; nglucose = b mol.
msaccharose = 2mglucose ⇒ 342a = 2 × 180b (1)
saccharose → fructose + glucose
∑nglucose = nglucose ban đầu + nglucose thủy phân = a + b mol.
nfructose = a mol.
1glucose → 2Ag, 1fructose → 2Ag
nAg = 2 × nglucose + 2 × nfructose = 2 × (a + b) + 2 × a = 64,8 : 108 = 0,6 mol. (2)
Từ (1)(2) ⇒ a = 0,1017 mol; b = 0,0966 mol
m = msaccharose + mglucose = 0,1017 × 342 + 0,0966 × 180 = 52,1694 gam.
Bài 8: Lên men m gam glucose với hiệu suất 90%, lượng khí CO2 sinh ra hấp thụ hết vào 200ml dung dịch nước vôi trong, nồng độ 0,75M. Sau phản ứng thu được 7,5 gam kết tủa trắng và khối lượng dung dịch tăng so với khối lượng dung dịch nước vôi trong ban đầu. Giá trị của m là:
A. 7,5. B. 15,0.
C. 22,5. D. 30,0.
Lời giải:
Đáp án: C
Hấp thụ CO2 vào dung dịch Ca(OH)2:
CO2 + Ca(OH)2 → CaCO3 + H2O (1)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (2)
nCaCO3 =
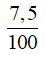
nCa(OH)2 (1) = nCa(OH)2 bđ - nCa(OH)2 (2) = 0,2.0,75 – 0,075 = 0,075 mol
nCO2 = nCO2 (1) + nCO2 (2) = 0,075 + 0,075.2 = 0,225 mol
C6H12O6 → 2CO2
nglucose thực tế = 0,5.0,225:90% = 0,125 mol
⇒ mglucose t.t = 0,125.180 = 22,5g
Bài 9: Lên men m gam glucose với hiệu suất 72%. Lượng CO2 sinh ra được hấp thụ hoàn toàn vào 500 ml dung dịch hỗn hợp gồm NaOH 0,1M và Ba(OH)2 0,2M, sinh ra 9,85 gam kết tủa. Giá trị lớn nhất của m là
A. 25,00. B. 18,75.
C. 6,25. D. 13,00.
Lời giải:
Đáp án: A
nOH- = 0,5.(0,1 + 0,2.2) = 0,25 mol
nBaCO3 = 0,05 mol; nBa2+ = 0,5.0,2 = 0,1 mol
Gía trị lớn nhất của m ứng với giá trị lớn nhất của CO2 ⇒ tạo 2 muối
OH- + CO2 → HCO3- (1)
2OH- + CO2 → CO32- + H2O (2)
⇒ nCO2 max = nCO2 (1) + nCO2 (2) = nBaCO3 + (nOH- - 2 nBaCO3) = 0,2 mol
⇒ nglucose = 1/2. nCO2 = 0,1 mol
⇒ mglucose thực tế = 0,1.180 : 72% = 25g
Bài 10: Từ 1,0 tấn mùn cưa chứa 50% Cellulose điều chế được bao nhiêu kg ethanol. Biết hiệu suất của mỗi quá trình thủy phân Cellulose và lên men glucose đều đạt 80%.
A. 181,73. B. 227,16.
C. 283,95. D. 363,46.
Lời giải:
Đáp án: A
[C6H10O5]n → 2nC2H5OH
1 tấn mùn cưa chứa 50% Cellulose nên mCellulose = mmùn cưa × 50% = 1000 × 50% = 500 kg.
Theo phương trình:
mC2H5OH lý thuyết =
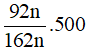
Ta có Hquá trình = H1 × H2 = 80% × 80% = 64%.
mC2H5OH thực tế = mC2H5OH lý thuyết × H = 283,95 × 64% = 181,73 kg.
Bài 11: Cho glucose lên men thành ethylic alcohol với hiệu suất 70%. Hấp thụ toàn bộ sản phẩm khí thoát ra vào 1 lít dung dịch NaOH 2M (d = 1,05 g/ml) thu được dung dịch chứa các muối có tổng nồng độ là 12,27%. Khối lượng glucose đã dùng là:
A. 192,86 gam. B. 182,96 gam.
C. 94,5 gam. D. 385,72 gam.
Lời giải:
Đáp án: A
Hấp thụ CO2 vào dung dịch NaOH
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3 + H2O
nNaHCO3 = a mol, nNa2CO3 = b mol.
nNaOH = a + 2b = 1 × 2 = 2 mol. (1)
mCO2 = (a + b) × 44 gam.
mdung dịch = mCO2 + mdd NaOH = 44(a + b) + 1000 × 1,05 = 44(a + b) + 1050 gam.
mNaHCO3 = 84a gam; mNa2CO3 = 106b gam.
C%NaHCO3 + C%Na2CO3 =
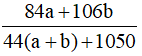
Từ (1) và (2) ⇒ nNaHCO3 = 1mol; nNa2CO3 = 0,5 mol.
∑nCO2 = a + b = 1 + 0,5 = 1,5 mol.
1C6H12O6 → 2CO2
Theo phương trình nC6H12O6 lý thuyết =
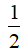
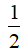
mC6H12O6 lý thuyết = 0,75 × 180 = 135 gam.
Mà H = 70% ⇒ mC6H12O6 thực tế = mC6H12O6 lý thuyết : H = 135 : 70% = 192,86 gam.
Bài 12: Cho glucose lên men rượu với hiệu suất 70%, hấp thụ toàn bộ sản phẩm khí thoát ra vào 2 lít dung dịch NaOH 0,5M (D = 1,05 g/ml) thu được dung dịch chứa hai muối với tổng nồng độ là 3,21%. Khối lượng glucose đã dùng là
A. 67,5 g. B. 135 g.
C. 192,86 g. D. 96,43 g.
Lời giải:
Đáp án: D
C6H12O6 → 2C2H5OH + 2CO2 (1)
CO2 + NaOH → NaHCO3 (2)
CO2 + 2NaOH → Na2CO3 + H2O (3)
Đặt nNaHCO3 = a (mol); nNa2CO3 = b (mol).
Theo phản ứng (2)(3) thì tổng số mol NaOH = a + 2b =1 (mol) (*)
mmuối = 84a + 106b (gam).
mddNaOH ban đầu = 2.103 . 1,05 = 2100 (g)
Theo phản ứng (2)(3), nCO2 = a + b ⇒ mCO2 = 44(a + b) (gam).
mdd thu được = 2100 + 44(a + b) (gam).
C% muối = (84a + 106b) : [2100 + 44(a + b)] = 3,21%
⇒ 82,5876a + 104,5876b = 67,41 (**)
Từ (*)(**) ⇒ a = 0,5 và b = 0,25.
nCO2 = a + b = 0,5 + 0,25 = 0,75 (mol).
nglucôzơ = 1/2. nCO2 = 0,75 : 2 = 0,375 (mol).
H = 70% ⇒ mglucôzơ đã dùng = 0,375.180 :70% = 96,43 (gam).
Bài 13: Cho m g glucose và fructose tác dụng với lượng dư dd AgNO3/NH3 tạo ra 43,2 g Ag. Cũng m g hỗn hợp này tác dụng vừa hết với 8 g Br2 trong dd. Số mol glucose và fructose trong hỗn hợp này lần lượt là:
A. 0,05 mol và 0,15 mol B. 0,10 mol và 0,15 mol.
C. 0,2 mol và 0,2 mol D. 0,05 mol và 0,35 mol
Lời giải:
Đáp án: A
nAg = 0,4 mol, ⇒ n(glucose + fructose) = 0,2 mol.
nBr2 = 0,05 mol ⇒ nglucose trong hỗn hợp = 0,05 mol,
⇒ nfructose = 0,15 mol
Bài 14: Cho lên men 1 m3 nước rỉ đường glucose thu được 60 lít cồn 96o. Khối lượng glucose có trong thùng nước rỉ đường glucose trên là bao nhiêu kilôgam? Biết khối lượng riêng của ethyl alcohol bằng 0,789 g/ml ở 20oC và hiệu suất quá trình lên men đạt 80%.
A. 71 kg B. 74 kg
C. 89 kg D. 111kg
Lời giải:
Đáp án: D
mdd ancol = 60000.0,789 = 47340(g)
⇒ mAncol nguyên chất = 0,96.47340 = 45446,4(g)
⇒ nC2H5OH = 45446,4:46 = 988(mol)
C6H12O6 → 2C2H5OH (H = 80% = 0,8)
⇒ nC6H12O6 = 1/2. nC2H5OH = 494mol
⇒ mglucose thực tế = 494.180 : 80% = 111150kg = 111,15kg
Bài 15:Từ 180 gam glucose, bằng phương pháp lên men rượu, thu được a gam ethyl alcohol (hiệu suất 80%). Oxi hoá 0,1a gam ethyl alcohol bằng phương pháp lên men giấm, thu được hỗn hợp X. Để trung hoà hỗn hợp X cần 720 ml dung dịch NaOH 0,2M. Hiệu suất quá trình lên men giấm là
A. 20% B. 10%
C. 80%. D. 90%
Lời giải:
Đáp án: D
C6H12O6 → 2C2H5OH + 2CO2
nC6H12O6 = 180:180 = 1 mol
⇒ nC2H5OH = 2.1.80% = 1,6 mol
⇒ Có 0,16 mol C2H5OH tham gia phản ứng lên men giấm
C2H5OH + O2 → CH3COOH + H2O
CH3COOH + NaOH → CH3COONa + H2O
nCH3COOH = nNaOH = 0,2.0,72 = 0,144 mol = nC2H5OH pư
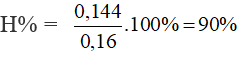
Bài 16: Phản ứng tổng hợp glucose trong cây xanh cần được cung cấp năng lượng là 2813 kJ cho mỗi mol glucose tạo thành: 6CO2 + 6H2O → C6H12O6 + 6O2. Trong 1 phút, mỗi cm2 lá xanh nhận được khoảng 2,09 J năng lượng mặt trời, nhưng chỉ có 10% được sử dụng vào phản ứng tổng hợp glucose. Một ngày nắng trong 11 giờ, diện tích lá xanh là 1 m2 thì khối lượng glucose tổng hợp được là
A. 90,12 B. 86,12
C. 88.27 D. 80,54
Lời giải:
Đáp án: C
6CO2 + 6H2O → C6H12O6 + 6O2
1cm2 = 10-4 m2
2813kJ = 2813000J cho 1mol C6H12O6
Trong 1 phút ở 10-4 m2 lá:
Lượng glucose tổng hợp = 2,09.10% = 0,209 J
Trong 660 phútvà 1m2 lá:
⇒ Năng lượng cần = 0,209.660:10-4 = 1379400 J
⇒ nC6H1206 = 1379400 : 2813000 = 0,49mol
⇒ mC6H1206 = 0,49.180 = 88,27(g)
Bài 17: Cho sơ đồ chuyển hóa sau : glucose → ethyl alcohol → but-1,3-dien → cao su buna Hiệu suất của toàn bộ quá trình điều chế là 75%, muốn thu được 32,4 kg cao su buna thì khối luợng glucose cần dùng là
A. 144 kg. B. 108 kg.
C. 81 kg. D. 96 kg.
Lời giải:
Đáp án: A
Ta có nhận xét về tỉ lệ các chất như sau :
1 glucose → 2 ethyl alcohol → 1 but - 1,3 - dien → 1 cao su buna
mcao su = 32,4g ⇒ nC4H6 = 32,4 : 54 = 0,6 kmol
⇒ nglucose = 0,6 kmol
⇒ mglucose = 0,6.180:75% = 144 kg
Bài 18: Cho 360 gam glucose lên men thành ethyl alcohol và cho toàn bộ khí CO2 sinh ra hấp thụ vào dung dịch NaOH dư được 318 gam muối. Hiệu suất phản ứng lên men là.
A. 80%. B. 75%.
C. 62,5%. D. 50%.
Lời giải:
Đáp án: B
C6H12O6 -lên men→ 2C2H5OH + 2CO2
Vì NaOH dư ⇒ Muối là Na2CO3
⇒ nCO2 = nNa2CO3 =
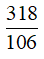
⇒ nC6H12O6 = 1,5 mol ⇒ mC6H12O6 = 270 g
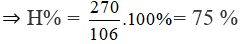
Bài 19: Đốt cháy hoàn toàn 9 gam hợp chất hữu cơ X (chứa C,H,O và MX < 200) rồi cho toàn bộ sản phẩm cháy hấp thụ hết vào bình chứa 2 lít dung dịch Ba(OH)2 0,1M. Sau thí nghiệm, khối lượng bình tăng 18,6 gam và có 0,1 mol kết tủa. Lọc lấy dung dịch và đem đun nóng lại thấy xuất hiện kết tủa. Mặt khác 1,8 gam X phản ứng với lượng dư dung dịch AgNO3/NH3 được 0,02 mol Ag. Công thức của X là.
A. HCHO. B. HOC2H4CHO.
C. C12H22O11. D. C6H12O6.
Lời giải:
Đáp án: D
Đốt cháy X tạo CO2, H2O ⇒ mCO2 + mH2O = 18,6 g
Vì khi đun nóng lại tạo kết tủa ⇒ CO2 + Ba(OH)2 → 2 muối
nOH- = 0,4 mol ⇒ nCO2 = nOH- - nkết tủa = 0,4 - 0,1 = 0,3 mol
⇒ mCO2 = 13,2 g
⇒ mH2O = 0,3 mol
BTKL ⇒ nO (trong X) = 0,3 mol
⇒ CT của X là (CH2O)n
Giả sử X có k nhóm CHO
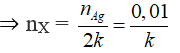
⇒ MX = 180k ⇒ k = 1; MX = 180
Khi đó, n = 6 ⇒ X là C6H12O6
Bài 20: Để tạo được 1 mol glucose từ sự quang hợp của cây xanh thì phải cần cung cấp năng lượng là 2 813kJ
6CO2 + 6H2O + 2 813kJ -ánh sáng→ C6H12O6 + 6O2
Giả sử trong một phút, 1cm2 bề mặt lá xanh hấp thu năng lượng mặt trời để dùng cho sự quang hợp là 0,2J. Một cây xanh có diện tích lá xanh có thể hấp thu năng lượng mặt trời là 1m2. Cần thời gian bao lâu để cây xanh này tạo được 36 gam glucose khi có nắng?
A. Khoảng 4 giờ 41phút B. Khoảng 8 giờ 20 phút
C. Khoảng 200 phút D. Một kết quả khác
Lời giải:
Đáp án: A
1 phút 1 cây xanh hấp thụ được 0,2.10000 = 2000 (J)
nGlucose cần tạo ra = 0,2 (mol) ⇒ cần năng lượng = 0,2 × 2813 = 562,6 ( kJ)
⇒ thời gian cần thiết = 562,6 × 1000 : 2000 = 281,3 (phút) = 4 giờ 41 phút
Bài 21: Lên men a gam glucose với hiệu suất 90%, lượng CO2 được hấp thụ hết bởi nước vôi trong thu được 10 gam kết tủa và khối lượng dung dịch giảm 3,4 gam. A có giá trị như thế nào?
A. 30,0 gam B. 13,5 gam
C. 20,0 gam D. 15,0 gam
Lời giải:
Đáp án: D
mgiảm = m↓ - mCO2 ⇒ mCO2 = 10 – 3,4 = 6,6g
⇒ nCO2 = 0,15 mol ⇒ nglucose = 0,075 mol
⇒ mglucose thực tế = 0,075.180 : 90% = 15g
Bài 22: Lên men a gam glucose với hiệu suất 75% , lượng CO2 sinh ra hấp thụ hết vào dung dịch Ca(OH)2 thu được 40 gam kết tủa .Tính a gam?
A. 50 gam B. 24 gam
C. 40 gam D. 48 gam
Lời giải:
Đáp án: D
C6H12O6 → 2C2H5OH + 2CO2 ( H = 75% )
CO2 + Ca(OH)2 → CaCO3 + H2O
Ta có nCO2 = nCaCO3 = 0,4 mol.
H = 75% ⇒ m glucose thực tế =
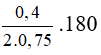
Bài 23: Đun nóng dung dịch chứa 18 gam hỗn hợp glucose và fructose với một lượng dư Cu(OH)2 trong môi trường kiềm tới khi phản ứng hoàn toàn tạo thành m gam kết tủa Cu2O. Giá trị của m là:
A. 14,4 B. 7,2
C. 5,4 D. 3,6
Lời giải:
Đáp án: A
Nhận thấy glucose và fructose đều phản ứng Cu(OH)2 trong môi trường kiềm
⇒ nglucose + nfructose = nCu2O ⇒ nCu2O = 18 : 180 = 0,1 mol ⇒ mCu2O = 14,4 gam.
Bài 24: Tính lượng kết tủa đồng(I) oxit tạo thành khi đun nóng dung dịch hỗn hợp chứa 9,00 gam glucose và lượng dư copper (II) hydroxide trong môi trường kiềm
A. 1,44 gam B. 3,60 gam
C. 7,20 gam D. 14,4 gam
Lời giải:
Đáp án: C
nGlu = 0,05 mol
Ta có: nglu = n-CHO = nCu2O = 0,05 mol
⇒ mCu2O = 0,05.144 = 7,2g
Bài 25: Khối lượng glucose chứa trong nước quả nho để sau khi lên men cho ta 100 lít rượu vang 10o là bao nhiêu? (Biết hiệu suất phản ứng lên men đạt 95%, ethyl alcohol nguyên chất có khối lượng riêng là 0,8g/ml. Giả thiết rằng trong nước quả nho chỉ có một chất đường glucose).
A. 32,952 kg B. 14,869 kg
C. 16,476 kg D. 15,26 kg
Lời giải:
Đáp án: D
Phương trình phản ứng: C6H12O6 -lên men→ 2C2H5OH + 2CO2 (H = 95%).
Khối lượng rượu có trong 100 lít rượu vang 10o là mrượu = 100 × 103 × 0,8 × 0,1 = 8000 gam
⇒ nrượu = 8000 : 46 =
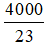
H = 95% ⇒ mglucose t.t =
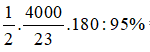
Bài 26: Lên men một lượng glucose thành ethyl alcohol thì thu được 100 ml ancol 46o. Khối lượng riêng của ancol nguyên chất là 0,8 gam/ml. Hấp thụ toàn bộ khí CO2 sinh ra trong quá trình lên men vào dung dịch NaOH dư thu được muối có khối lượng là (các phản ứng xảy ra hoàn toàn)
A. 106 gam B. 84,8 gam
C. 212 gam D. 169,6 gam
Lời giải:
Đáp án: B
mC2H5OH nguyên chất = 100. 0,46.0,8 = 36,8
⇒ nCO2 = nC2H5OH = 0,8 mol
⇒ mNa2CO3 = 0,8.106 = 84,8g
Bài 27: Hỗn hợp A gồm glucose và tinh bột được chia đôi. Phần thứ nhất được khuấy trong nước, lọc và cho nước lọc phản ứng với dung dịch AgNO3(dư)/NH3 thấy tách ra 2,16 gam Ag. Phần thứ hai được đun nóng với dung dịch H2SO4 loãng, trung hoà hỗn hợp thu được bằng dung dịch NaOH rồi cho sản phẩm tác dụng với dung dịch AgNO3(dư)/NH3 thấy tách ra 6,48 gam Ag. Giả sử các phản ứng xảy ra hoàn toàn. Hỗn hợp ban đầu có % khối lượng mỗi chất là
A. 64,29% glucose và 35,71% tinh bột về khối lượng
B. 64,71% glucose và 35,29% tinh bột về khối lượng
C. 35,29% glucose và 64,71% tinh bột về khối lượng
D. 35,71% glucose và 64,29% tinh bột về khối lượng
Lời giải:
Đáp án: D
Phần 1:
Chỉ có glucose tham gia phản ứng tráng gương:
nglucose = 1/2. nAg = 0,01 mol
Phần 2:
Thủy phân a mol tinh bột → a.n mol glucose
Ta có: a.n + 0,01 = 1/2. nAg = 0,03 ⇒ a.n = 0,02 mol
%mglucose =
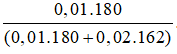
⇒ %mtinh bột = 100% - 35,71% = 64,29%
Bài 28: Hiđro hoá hoàn toàn m gam hỗn hợp gồm glucose và fructose cần phải dùng 4,48lít khí H2 ở đktc. Mặt khác, cũng m gam hỗn hợp này tác dụng vừa hết với 8 gam Br2 trong dung dịch. Số mol của glucose và fructose trong m gam hỗn hợp này lần lượt là:
A. 0,05mol và 0,15mol B. 0,05mol và 0,35mol
C. 0,1mol và 0,15mol D. 0,2mol và 0,2mol
Lời giải:
Đáp án: A
Hỗn hợp glucose và fructose chỉ có glucose tham gia phản ứng với Br2
nglucose = nBr2 = 0,05 mol
nglu + nfruc = nH2 = 0,2 mol
⇒ nfruc = 0,2 – 0,05 = 0,15 mol
Bài 29: Lên men 360 gam glucose trong điều kiện thích hợp (giả sử chỉ có phản ứng tạo thành ethyl alcohol). Cho toàn bộ lượng khí CO2 sinh ra hấp thụ hết vào dung dịch NaOH, thu được 106 gam Na2CO3 và 168 gam NaHCO3. Hiệu suất của phản ứng lên men gluczơ là :
A. 50% B. 62,5%
C. 80% D. 75%
Lời giải:
Đáp án: D
Hấp thụ CO2 vào dung dịch NaHCO3
CO2 + NaOH → NaHCO3 (1)
CO2 + 2NaOH → Na2CO3 + H2O (2)
nCO2 (1) = nNaHCO3 = 168 : 84 = 2 mol
nCO2 (2) = nNa2CO3 = 106 : 106 = 1 mol
⇒ nCO2 thực tế = 2 + 1 =3 mol
Theo phương trình:
nCO2 = 2nglucose =
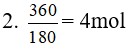
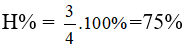
Bài 30: Khối lượng copper (II) hydroxide phản ứng vừa đủ với dung dịch chứa 9 gam glucose tạo dung dịch màu xanh lam là:
A. 1,225g B. 4,9g
C. 2,45g D. 24,5g
Lời giải:
Đáp án: C
2C6H12O6 + Cu(OH)2 → 2H2O + (C6H11O6)2O
nCu(OH)2 = 1/2 nglu =
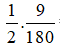
mCu(OH)2 = 0,025.98 = 2,45g
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Bài tập lipid cơ bản, nâng cao có lời giải chi tiết
- Bài tập Peptit cơ bản có lời giải chi tiết
- Bài tập Peptit nâng cao có lời giải chi tiết
- Bài tập polymer cơ bản, nâng cao có lời giải chi tiết
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

