Kim loại chuyển tiếp dãy thử nhất là gì (chi tiết nhất)
Bài viết Kim loại chuyển tiếp dãy thử nhất là gì lớp 12 chi tiết nhất là kiến thức có trong chương trình Hóa học 12 giúp học sinh nắm vững kiến thức trọng tâm về Kim loại chuyển tiếp dãy thử nhất.
Kim loại chuyển tiếp dãy thử nhất là gì (chi tiết nhất)
1. Kim loại chuyển tiếp dãy thử nhất là gì?
- Các nguyên tố từ Sc (Z = 21) đến Cu (Z = 29) được gọi là nguyên tố chuyển tiếp dãy thứ nhất.
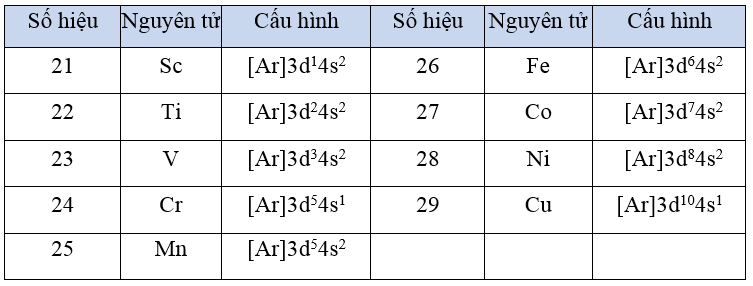
- Cấu hình electron của nguyên tử các nguyên tố kim loại chuyển tiếp dãy thứ nhất được cho trong bảng sau:
- Đặc điểm cấu hình electron trong nguyên tử của các kim loại chuyển tiếp dãy thứ nhất đều có lớp vỏ bên trong của khí hiếm Ar. Số electron trên phân lớp 3d tăng dần từ 1 (ở Sc) đến 10 (ở Cu). Trong khi đó trên phân lớp 4s, số electron thường bằng 2 (trừ Cr và Cu).
- Nguyên tử của các kim loại chuyển tiếp dãy thứ nhất có nhiều electron hoá trị thuộc phân lớp 3d và 4s nên kim loại chuyển tiếp dây thứ nhất thường tạo thành các hợp chất với nhiều số oxi hoá khác nhau.
Chú ý:
+ Kim loại chuyển tiếp gồm toàn bộ các nguyên tố họ d và họ f, đều thuộc nhóm B trong bảng tuần hoàn
+ Nguyên tố họ d gồm 4 dãy: dãy 3d (chu kì 4), dãy 4d (chu kì 5), dãy 5d (chu kì 6) và dãy 6d (chu kì 7). Nguyên tố họ f gồm 2 dãy: dãy 4f (họ lanthanides, chu kì 6) và dãy 5f (họ actinides, chu kì 7).
2. Bài tập minh họa
2.1. Tính chất vật lí và ứng dụng của kim loại chuyển tiếp
|
Tính chất |
Đặc điểm |
Ứng dụng |
|
Nhiệt độ nóng chảy |
Khó nóng chảy, đặc biệt là vanadium, chromium và cobalt. |
Chế tạo dụng cụ, máy móc, thiết bị làm việc ở nhiệt độ cao. |
|
Độ cứng |
Khá cao, chromium là kim loại cứng nhất trong tất cả các kim loại. |
Chế tạo hợp kim không gỉ hoặc siêu cứng để sản xuất dụng cụ y tế, nhà bếp, vòng bi, mũi khoan,... |
|
Khối lượng riêng |
Scandium và titanium tương đối nhẹ. Các kim loại khác đều là kim loại nặng. |
Chế tạo vật liệu hàng không, gọng kính. Sản xuất phương tiện giao thông, máy móc, bệ máy,... |
|
Độ dẫn điện |
Tương đối tốt, đồng là kim loại dẫn điện tốt (chỉ sau bạc). |
Chế tạo dây dẫn, thiết bị điện,... |
|
Độ dẫn nhiệt |
Tương đối tốt, điển hình là đồng. |
Chế tạo thiết bị nồi hơi thiết bị trao đổi nhiệt, đồ gia dụng,.. |
2.2. Hợp chất của kim loại chuyển tiếp dãy thứ nhất
a. Số oxi hoá của nguyên tử kim loại chuyển tiếp dãy thứ nhất trong hợp chất
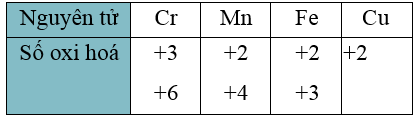
- Do có nhiều electron hoá trị (ở phân lớp 4s và 3d) nên các nguyên tố chuyển tiếp dãy thứ nhất có khả năng tạo ra các hợp chất với nhiều trạng thái oxi hoá khác nhau.
- Khi tham gia phản ứng hoá học, nguyên tử kim loại chuyển tiếp dãy thứ nhất ưu tiên nhường electron ở phân lớp 4s trước rồi đến electron ở phân lớp 3d, tạo thành các cation tương ứng.
Ví dụ:
b. Màu sắc của các ion kim loại chuyển tiếp dãy thứ nhất
Các ion kim loại chuyển tiếp dãy thứ nhất có màu sắc phong phú.
c. Chuẩn độ iron(II) sulfate bằng thuốc tím
Trong phòng thí nghiệm, nồng độ iron(II) sulfate có thể được xác định bằng phương pháp chuẩn độ với dung dịch thuốc tím trong môi trường sulfuric acid theo phương trình hoá học:
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
d. Nhận biết một số ion kim loại chuyền tiếp
Trong hoá học, các ion kim loại chuyển tiếp thường được nhận biết dựa vào màu sắc đặc trưng của ion, của hợp chất ít tan hoặc của phức chất tương ứng.
3. Bài tập minh họa
Câu 1. Dung dịch nào sau đây có màu vàng chanh?
A. CuSO4.
B. FeCl3.
C. KMnO4.
D. FeSO4.
Hướng dẫn giải
Đáp án đúng là: B
Dung dịch FeCl3 có màu vàng chanh.
Câu 2. Cấu hình electron nào sau đây là của ion Fe2+?
A. [Ar]3d6.
B. [Ar]3d5.
C. [Ar]3d4.
D. [Ar]3d3.
Hướng dẫn giải
Đáp án đúng là: A
Cấu hình electron của Fe: [Ar]3d64s2 ⟹ ion Fe2+: [Ar]3d6.
Câu 3. Nhỏ từ từ dung dịch H2SO4 loãng vào dung dịch K2CrO4 thì màu của dung dịch chuyển từ
A. không màu sang màu vàng.
B. màu da cam sang màu vàng.
C. không màu sang màu da cam.
D. màu vàng sang màu da cam.
Hướng dẫn giải
Đáp án đúng là: D
Muối cromat có màu vàng, muối có màu da cam đều bền. Trong dung dịch có cân bằng: + 2H+ ⟺ + H2O. Vì vậy, khi nhỏ từ dung dịch H2SO4 loãng, dư vào dung dịch K2CrO4 thì cân bằng trên sẽ chuyển dịch về phía bên phải (phía làm giảm nồng độ H+) màu của dung dịch chuyển từ màu vàng sang màu da cam.
Câu 4. Mô tả phù hợp với thí nghiệm nhúng thanh Cu (dư) vào dung dịch FeCl3 là
A. bề mặt thanh kim loại đồng có màu trắng hơi xám.
B. dung dịch từ màu vàng nâu chuyển dần qua màu xanh.
C. dung dịch có màu vàng nâu.
D. khối lượng thanh đồng kim loại tăng lên.
Hướng dẫn giải
Đáp án đúng là: B
Khi nhúng thanh Cu (dư) vào dung dịch FeCl3 thì dung dịch từ màu vàng nâu (của FeCl3) chuyển dần qua màu xanh (của CuCl2, 2FeCl2): Cu + 2FeCl3 ⟶ CuCl2 + 2FeCl2
Câu 5. Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử thay đổi như thế nào?
A. Tăng dần.
B. Không đổi.
C. Giảm dần.
D. Không có quy luật.
Hướng dẫn giải
Đáp án đúng là: C
Trong dãy nguyên tử Sc, Ti, V, Cr bán kính nguyên tử giảm dần từ Sc đến Cr.
Câu 6. Ion nào sau đây không có electron trên phân lớp 3d và không có màu trong dung dịch nước?
A. Fe3+.
B. Cr3+.
C. Ti3+.
D. Sc3+.
Hướng dẫn giải
Đáp án đúng là: D
Sc có cấu hình e là: [Ar]3d14s2 ⟹ Sc3+ có cấu hình e: [Ar]. Sc3+ không có electron trên phân lớp 3d và không có màu trong dung dịch nước.
Câu 7. Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở
A. phân lớp 3d và phân lớp 4s.
B. phân lớp 3d.
C. lớp 4s.
D. phân lớp 3p và phân lớp 3d.
Hướng dẫn giải
Đáp án đúng là: A
Các electron hoá trị của nguyên tử nguyên tố kim loại chuyển tiếp dãy thứ nhất phân bố ở phân lớp 3d và phân lớp 4s.
Câu 8. Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là
A. [Ne]3d1÷104s1÷2.
B. [Ar]3d1÷104s1÷2.
C. [Ar]3d1÷104s2.
D. [Ar]3d104s1÷2.
Hướng dẫn giải
Đáp án đúng là: B
Đặc điểm chung cấu hình electron của nguyên tử kim loại chuyển tiếp dãy thứ nhất là [Ar]3d1÷104s1÷2.
Câu 9. Để phân biệt dung dịch H2SO4 đặc nguội và dung dịch HNO3 đặc nguội, có thể dùng kim loại nào sau đây?
A. Cr.
B. Al.
C. Fe.
D. Cu.
Hướng dẫn giải
Đáp án đúng là: D
Cr, Al, Fe đều thụ động hóa trong H2SO4 đặc nguội và dung dịch HNO3 đặc nguội nên không thể dùng 3 kim loại này.
Cu tác dụng với H2SO4 đặc nguội cho khí SO2 không màu và tác dụng với dung dịch HNO3 đặc nguội cho khí NO2 màu nâu đỏ.
Câu 10. Muối nào sau đây vừa có khả năng thể hiện tính oxi hóa (trong môi trường acid), vừa có khả năng thể hiện tính khử (trong môi trường kiềm)?
A. K2Cr2O7.
B. Cr2(SO4)3.
C. K2CrO4.
D. Na2CrO4.
Hướng dẫn giải
Đáp án đúng là: B
Nguyên tử Cr trong muối Cr2(SO4)3 có số oxi hóa là +3, có khả năng thể hiện tính khử (lên +6) hoặc tính oxi hóa (về +2 hoặc 0).
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

