Nguyên tử trung tâm trong phức chất là gì (chi tiết nhất)
Bài viết Nguyên tử trung tâm trong phức chất là gì lớp 12 chi tiết nhất là kiến thức có trong chương trình Hóa học 12 giúp học sinh nắm vững kiến thức trọng tâm về Nguyên tử trung tâm trong phức chất.
Nguyên tử trung tâm trong phức chất là gì (chi tiết nhất)
1. Nguyên tử trung tâm trong phức chất là gì?
- Nguyên tử trung tâm là cation hoặc nguyên tử kim loại (thường được kí hiệu là M) liên kết với phối tử (thường được kí hiệu là L) để tạo nên phức chất.
Ví dụ: Phức chất [Ag(NH3)2]+ có nguyên tử trung tâm là Ag+.
2. Kiến thức mở rộng
2.1. Một số khái niệm cơ bản về phức chất
- Phức chất là hợp chất có chứa nguyên tử trung tâm (thường được kí hiệu là M) và các phối tử (thường được kí hiệu là L).
Trong đó:
+ Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại liên kết với các phối tử.
+ Phối tử là anion hoặc phân tử.
+ Phức chất có thể mang điện tích hoặc không mang điện tích.
+ Trong công thức phức chất, nguyên tử trung tâm M và các phối tử L thường được đặt trong móc vuông.
- Ví dụ 1: Phức chất [Co(NH3)6]3+ có điện tích là +3, nguyên tử trung tâm là Co3+ và phối tử là NH3.
- Ví dụ 2: Phức chất [Zn(OH)4]2- có điện tích là -2, nguyên tử trung tâm là Zn2+ và phối tử là OH-.
Chú ý:
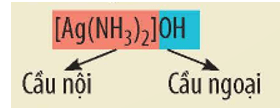
+ Trong công thức của phức chất, cầu nội được đặt trong móc vuông. Cầu nội của phức chất gồm nguyên tử trung tâm M và các phối tử L. Khi cầu nội mang điện tích, phức chất thường chứa ion cầu ngoại, các ion này trung hòa điện tích với ion cầu nội
Ví dụ:
+ Trong nhiều trường hợp, người ta chỉ quan tâm đến cầu nội do nó quyết định tính chất của phức chất.
Ví dụ: Trong dung dịch thuốc thử Tollens, phức [Ag(NH3)2]OH phân li như sau:
[Ag(NH3)2]OH [Ag(NH3)2]+ + OH-
Cation cầu nội [Ag(NH3)2]+ quyết định tính chất của thuốc thử Tollens.
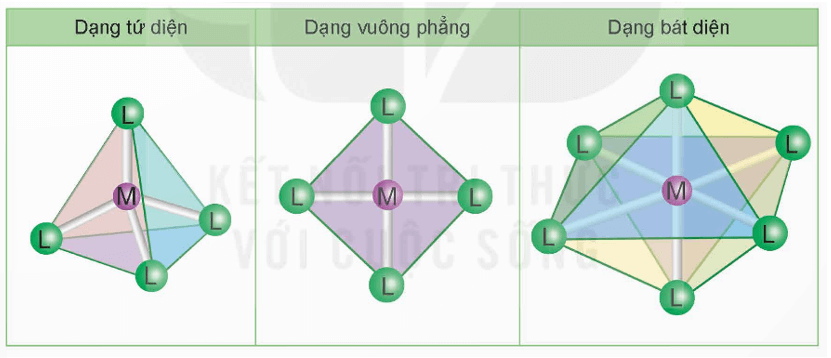
2.2. Một số dạng hình học của phức chất
Trong phức chất [MLn] (điện tích đã dược lược bỏ), các phối tử L sắp xếp một cách xác định xung quanh nguyên tử trung tâm M tạo ra các dạng hình học khác nhau, phổ biến là dạng tứ diện, vuông phẳng và bát diện.
Chú ý: Nét màu xanh nối các phối tử L trong phức chất để chỉ rõ dạng hình học của phức chất, nét màu trắng chỉ liên kết giữa M và L.
2.3. Liên kết trong phức chất
a. Liên kết giữa nguyên tử trung tâm và phối tử
- Liên kết hóa học giữa nguyên tử trung tâm M và phối tử L trong phức chất là liên kết cho – nhận, được hình thành nhờ sự cho cặp electron chưa liên kết của phối tử vào orbital trống của nguyên tử trung tâm.
- Ví dụ:
+ Liên kết trong phức chất [Co(OH)4]2- được hình thành do phối tử OH- cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Co3+.
+ Liên kết trong phức chất [Zn(NH3)6]3+ được hình thành do phối tử NH3 cho cặp electron chưa liên kết vào AO trống của nguyên tử trung tâm Zn2+.
b. Sự hình thành phức chất aqua của một số ion kim loại chuyển tiếp
Trong dung dịch, các ion kim loại chuyển tiếp Mn+ thường nhận cặp electron chưa liên kết của H2O tạo thành liên kết cộng hóa trị kiểu cho - nhận, hình thành phức chất aqua. Hầu hết các phức chất aqua có dạng hình học bát diện ([M(H2O)6]n+).
3. Bài tập minh họa
Câu 1. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết
A. cho − nhận.
B. cộng hóa trị phân cực.
C. ion.
D. cộng hóa trị không phân cực.
Hướng dẫn giải
Đáp án đúng là: A.
Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho − nhận.
Câu 2. Nguyên tử trung tâm trong phức chất Na2[Zn(OH)4] là
A. Na+.
B. Zn2+.
C. O2−.
D. OH−.
Hướng dẫn giải
Đáp án đúng là: B.
Zn2+ là nguyên tử trung tâm, liên kết cho − nhận với 4OH−.
Câu 3. Cho phát biểu sau: “Phức chất đơn giản thường có một ...(1)... liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết ...(2)....”. Cụm từ cần điền vào (1) và (2) lần lượt là
A. cation kim loại, ion.
B. nguyên tử kim loại, cho − nhận.
C. nguyên tử trung tâm, cho − nhận.
D. phối tử, ion.
Hướng dẫn giải
Đáp án đúng là: C
Phức chất đơn giản thường có một nguyên tử trung tâm, liên kết với các phối tử bao quanh. Liên kết giữa nguyên tử trung tâm và phối tử trong phức chất là liên kết cho − nhận.
Câu 4. Nguyên tử trung tâm của phức [Co(NH3)6]3+ là ?
A. N.
B. Co.
C. Co3+.
D. NH3.
Hướng dẫn giải
Đáp án đúng là: C
Nguyên tử trung tâm của phức [Co(NH3)6]3+ là Co3+ (do ammonia không mang điện tích, điện tích 3+ phải thuộc về nguyên tử trung tâm).
Câu 5. Nguyên tử trung tâm của các phức chất [PtCl4]2- và [Fe(CO)5] lần lượt là
A. Pt4+ và Fe2+.
B. Pt2+ và Fe2+.
C. Cl và CO.
D. Pt2+ và Fe.
Hướng dẫn giải
Đáp án đúng là: D
Nguyên tử trung tâm của các phức chất [PtCl4]2- và [Fe(CO)5] lần lượt là Pt2+ và Fe.
Câu 6. Điện tích của nguyên tử trung tâm trong phức chất [Co(NH3)6]3+ và [FeF6]3- lần lượt là
A. +3 và +3
B. +3 và +2.
C. +6 và -6.
D. +3 và -3.
Hướng dẫn giải
Đáp án đúng là: D
Điện tích của nguyên tử trung tâm trong phức chất [Co(NH3)6]3+ và [FeF6]3- lần lượt là +3 và -3.
Câu 7. Cho phức chất [Cr(NH3)6]3+, phát biểu nào sau đây về phức chất này là không đúng?
A. Phức chất trên có nguyên tử trung tâm là NH3.
B. Phức chất trên có điện tích là 3+.
C. Trong phức [Cr(NH3)6]3+, NH3 đóng vai trò là phối tử.
D. Liên kết giữa phối tử NH3 và nguyên tử trung tâm Cr là liên kết cho-nhận.
Hướng dẫn giải
Đáp án đúng là: A
A. Sai vì nguyên tử trung tâm là Cr3+.
Câu 8. Phát biểu nào sau đây không đúng?
A. Phức chất đơn giản thường có một nguyên tử trung tâm liên kết với các phối tử bao quanh.
B. Phức chất có thể mang điện tích hoặc không mang điện tích như ở phức chất.
C. Phối tử là các phân tử hoặc anion đã cho cặp electron chưa liên kết.
D. Nguyên tử trung tâm là cation kim loại hoặc nguyên tử kim loại không còn orbital trống.
Hướng dẫn giải
Đáp án đúng là: D
D. Sai vì nguyên tử kim loại còn orbital trống
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

