Bài tập Axit tác dụng với bazơ (chọn lọc, có đáp án)
Bài viết Axit tác dụng với bazơ với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Axit tác dụng với bazơ.
Bài tập Axit tác dụng với bazơ (chọn lọc, có đáp án)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Bài 1: Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh
B. Làm quỳ tím hoá đỏ
C. Phản ứng được với magiê giải phóng khí hidrô
D. Không làm đổi màu quỳ tím
Bài 2: Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu xanh trên thì:
A. Màu xanh vẫn không thay đổi.
B. Màu xanh nhạt dần rồi mất hẳn
C. Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ
D. Màu xanh đậm thêm dần
Bài 3: Cho 200ml dung dịch KOH 1M tác dụng với 200ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là:
A. 2,24 lít B. 4,48 lít C. 3,36 lít D. 6,72 lít
Bài 4: Để trung hoà 200ml hỗn hợp chứa HCl 0,3M và H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là:
A. 400 ml B. 350 ml C. 300 ml D. 250 ml
Bài 5: Cho dung dịch chứa 0,9 mol NaOH vào dung dịch có chứa a mol H3PO4. Sau phản ứng chỉ thu được muối Na3PO4 và H2O. Giá trị của a là:
A. 0,3 mol B. 0,4 mol C. 0,6 mol D. 0,9 mol
Bài 6: Trung hòa 200 g dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là:
A. 200g B. 300g C. 400g D. 500g
Bài 7: Trung hoà hoàn toàn 200ml dung dịch KOH 0,5M bằng 200g dung dịch HCl a%. Nồng độ phần trăm của dung dịch ( a%) là:
A. 1,825% B. 3,650% C. 18,25% D. 36,50%
Bài 8: Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 g B. 16,475 g C. 17,475 g D. 18,645 g
Bài 9: Cho 200ml dung dịch KOH 1M tác dụng với 300ml dung dịch H2SO4 1M, sau phản ứng cho thêm một mảnh Mg dư vào sản phẩm thấy thoát ra một thể tích khí H2 (đktc) là:
A. 2,24 lít B. 4,48 lít C. 3,36 lít D. 6,72 lít
Bài 10: Để trung hoà 200ml H2SO4 0,1M cần dùng V (ml) dung dịch Ba(OH)2 0,2M. Giá trị của V là:
A. 400 ml B. 350 ml C. 300 ml D. 100 ml
Đáp án và hướng dẫn giải
| 1. A | 2. C | 3. A | 4. D | 5. A |
| 6. D | 7. A | 8. C | 9. B | 10. D |
Bài 1: Theo bài ta có:
nBa(OH)2 = 0,1.0,1 = 0,01 mol
nHCl = 0,1.0,1 = 0,01 mol
Theo PTHH, ta có:
Ba(OH)2 + 2HCl → BaCl2 + H2O
Bđ…...................0,01 …..…0,01…………………….. mol
Pư……………….0,005……..0,01……0,005…………mol
Sau pư………….0,005……….0……….0,005………..mol
Vậy sau phản ứng bazo Ba(OH)2 còn dư → dd sau phản ứng có môi trường bazo
→ Làm quỳ tím hóa xanh.
⇒ Chọn A.
Bài 2: HCl trung hòa bazo KOH làm dd chuyển dần từ màu xanh sang không màu, đến khi HCl dư, dd lại chuyển từ không màu sang màu đỏ.
⇒ Chọn C.
Bài 3:
2KOH + H2SO4 → K2SO4 + 2H2O (1)
Mg + H2SO4 → MgSO4 + H2 (2)
Theo bài ta có:
nKOH = 0,2.1 = 0,2 mol
nH2SO4 = 0,2.1 = 0,2 mol
Theo phương trình (1) ta có:
nKOH pư = 0,2 mol
nH2SO4 = 1/2 nKOH = 0,1 mol
nH2SO4 dư (1) = 0,2-0,1 = 0,1 mol
Theo phương trình (2) ta có:
nMg pư = nH2SO4 dư (1) = nH2 = 0,1 mol
→ VH2 = 0,1.22,4 = 2,24 mol
⇒ Chọn A.
Bài 4:
Ba(OH)2 + 2HCl → BaCl2 + 2H2O (1)
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O (2)
Theo bài, ta có:
Theo PTPU, ta có:
nBa(OH)2(1) = 1/2 nHCl = 0,03 mol
nBa(OH)2(2) = nH2SO4 = 0,02 mol
nBa(OH)2 can = nBa(OH)2(1) + nBa(OH)2(2) =0,05 mol
VBa(OH)2 can = 0,05/0,2 = 0,25 lit = 250ml
⇒ Chọn D.
Bài 5:
3NaOH + H3PO4 → Na3PO4 + 3H2O
⇒ mBaSO4 ↓ = 0,075.223 = 17,475 g
Theo PTHH, ta có:
nH3PO4 = 1/3 nNaOH = 0,3 mol = a
⇒ Chọn A.
Bài 6:
NaOH + HCl → NaCl + H2O
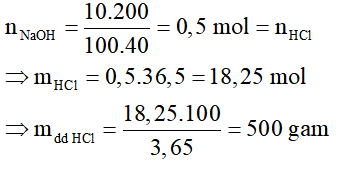
⇒ Chọn D.
Bài 7: Tương tự bài 6.
⇒ Chọn A.
Bài 8:
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Theo bài ta có:
nBa(OH)2 = 0,4.0,2 = 0,08 mol
nH2SO4 = 0,3.0,25 = 0,075 mol
Theo PTHH ta có:
nH2SO4 = nBa(OH)2 pư = 0,075 mol = nBaSO4↓
mBaSO4↓ = 0,075.223= 17.475 g
⇒ Chọn C.
Bài 9: Tương tự bài 3.
⇒ Chọn B.
Bài 10: Tương tự bài 4.
⇒ Chọn D.
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm các dạng bài tập Hóa học lớp 9 có đáp án, hay khác:
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

