Cách giải bài tập Axit tác dụng với bazơ (hay, chi tiết)
Bài viết Cách giải bài tập Axit tác dụng với bazơ với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Axit tác dụng với bazơ.
Cách giải bài tập Axit tác dụng với bazơ (hay, chi tiết)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Lý thuyết và Phương pháp giải
Phản ứng axit tác dụng với bazơ còn được gọi là phản ứng trung hoà. Axit HnA tác dụng với bazơ M(OH)m tạo muối và nước.
mHnA + nM(OH)m → MnAm + m.nH2O
Lưu ý:
-Nếu bài toán là hỗn hợp các axit và bazơ tác dụng với nhau, ta tính toán theo phương trình ion rút gọn:
H+ + OH- → H2O
-Trong một hỗn hợp mà có nhiều phản ứng xảy ra thì phản ứng trung hoà được ưu tiên xảy ra trước.
Phương pháp giải:
- Bước 1: Viết PTHH xảy ra.
- Bước 2: Tính toán theo phương trình hoá học, đặt ẩn số nếu bài toán là hỗn hợp.
- Bước 3: Lập phương trình và giải hệ phương trình ⇒ Số mol các chất cần tìm.
- Bước 4: Tính toán theo yêu cầu của bài toán.
Bài tập vận dụng
Bài 1: Cần bao nhiêu ml dung dịch KOH 1,5M để trung hoà 300ml dung dịch H2SO4 0,75M.
Lời giải:
PTHH:
2KOH + H2SO4 → K2SO4 + 2H2O
Theo đề bài, ta có:
nH2SO4 = 0,75.0.3 = 0,225 mol ⇒ nKOH = 2.nH2SO4 =2.0,225 = 0,45 mol
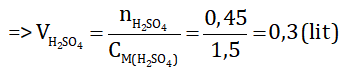
Vậy cần 300 ml dung dịch KOH 1,5M để trung hoà dung dịch axit sunfuric.
Bài 2: Để trung hoà 10ml dung dịch hỗn hợp axit gồm H2SO4 và HCl cần dùng 40ml dung dịch NaOH 0,5M. Mặt khác, lấy 100ml dung dịch axit đem trung hoà một lượng xút vừa đủ rồi cô cạn thì thu được 13,2g muối khan. Tính nồng độ mol/l của mỗi axit trong dung dịch ban đầu.
Lời giải:
NaOH + HCl → NaCl + H2O
2NaOH + H2SO4 → Na2SO4 + H2O
Hay: H+ + OH- → H2O
Gọi nồng độ của axit HCl và axit H2SO4 lần lượt là xM và yM.
Theo đề bài, ta tính được số mol NaOH dùng để trung hoà 10ml hỗn hợp axit là: nNaOH(1) = 0,5.0,04 = 0,02 mol
⇒ Phương trình 1:
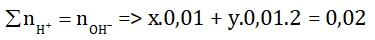
Mặt khác, tổng khối lượng muối khan thu được khi trung hoà 100ml hỗn hợp axit là 13,2g.
⇒ Phương trình 2: mmuối = mNaCl + m ⇒ x.0,1.58,5 + y.0,1.142 = 13,2
Giải hệ phương trình:
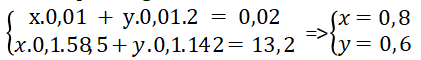
Vậy nồng độ mol của axit HCl là 0,8M và của axit H2SO4 là 0,6M
Bài tập tự luyện
Câu 1: Cho 50 ml dung dịch HCl 0,1 M tác dụng với 50 ml dung dịch NaOH 0,12 M thu được dung dịch A. Cho quỳ tím vào dung dịch A, quỳ tím đổi sang màu
A. Đỏ.
B. Tím.
C. Xanh.
D. Vàng.
Câu 2: Khi cho 100 ml dung dịch KOH 1 M vào 100 ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol của HCl đã dùng là
A. 0,75 (M).
B. 1 (M).
C. 0,25 (M).
D. 0,5 (M).
Câu 3: Trung hòa 100 gam dung dịch A chứa hỗn hợp HCl và H2SO4 cần vừa đủ 100 ml dung dịch B chứa NaOH 0,8 M và Ba(OH)2 0,6 M thu được 11,65 gam kết tủa. Nồng độ phần trăm của HCl trong dung dịch A là
A. 7,30%.
B. 5,84%.
C. 5,00%.
D. 3,65%.
Câu 4: Cho 100 ml dung dịch Ba(OH)2 1 M vào 100 ml dung dịch H2SO4 1 M, dung dịch thu được sau phản ứng có môi trường
A. Acid.
B. Trung tính.
C. Base.
D. Không xác định được.
Câu 5: Cho 1,25 lít dung dịch KOH 1M tác dụng vừa đủ với x lít dung dịch HCl 0,5 M. Giá trị của x là
A. 1,25
B. 2,0
C. 2,5
D. 2,75
Câu 6: Khối lượng dung dịch NaOH 10% cần để trung hoà 200 ml dung dịch HCl 1M là
A. 80 (g).
B. 100 (g).
C. 160 (g).
D. 200 (g).
Câu 7: Chuẩn độ 20 ml dung dịch HCl chưa biết nồng độ đã dùng hết 17 ml dung dịch NaOH 0,12 M. Nồng độ mol của dung dịch HCl là
A. 0,102 (M).
B. 0,08 (M).
C. 0,12 (M).
D. 0,112 (M).
Câu 8: Chuẩn độ 20 ml dung dịch hỗn hợp HCl 0,1M + HNO3 a mol/l cần dùng hết 16,5 ml dung dịch hỗn hợp KOH 0,1 M và Ba(OH)2 0,05 M. Giá trị của a là
A. 0,07.
B. 0,08.
C. 0,065.
D. 0,068.
Câu 9: Để chuẩn độ 50 ml dung dịch CH3COOH chưa biết nồng độ đã dùng trung bình hết 75 ml dung dịch NaOH 0,05 M. Nồng độ mol của dung dịch CH3COOH là
A. 0,075 (M).
B. 0,085 (M).
C. 0,125 (M).
D. 0,112 (M).
Câu 10: Một mẫu dung dịch H2SO4 (gọi là mẫu A) được phân tích bằng cách thêm 50,0 ml dung dịch NaOH 0,213 M vào 100 ml dung dịch mẫu A rồi lắc đều. Sau khi phản ứng xảy ra, người ta thấy trong hỗn hợp dung dịch còn dư ion OH−. Phần ion dư này cần 13,21 ml HCl 0,103 M để trung hoà. Nồng độ mol của mẫu A là
A. 0,646 (M).
B. 0,0646 (M).
C. 0,0464 (M).
D. 0,464 (M).
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm các dạng bài tập Hóa học lớp 9 có đáp án, hay khác:
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

