Tổng hợp lý thuyết Phi kim; Sơ lược về bảng tuần hoàn các nguyên tố hóa học (hay, chi tiết)
Tổng hợp lý thuyết Phi kim; Sơ lược về bảng tuần hoàn các nguyên tố hóa học lớp 9 hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm Hóa học 9.
Tổng hợp lý thuyết Phi kim; Sơ lược về bảng tuần hoàn các nguyên tố hóa học (hay, chi tiết)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
- Lý thuyết Tính chất của phi kim (hay, chi tiết)
- Lý thuyết Clo (hay, chi tiết)
- Lý thuyết Cacbon (hay, chi tiết)
- Lý thuyết Các oxit của cacbon (hay, chi tiết)
- Lý thuyết carbonic acid và muối carbonate (hay, chi tiết)
- Lý thuyết Silic. Công nghiệp silicat (hay, chi tiết)
- Lý thuyết Sơ lược về bảng tuần hoàn các nguyên tố hóa học (hay, chi tiết)
- Lý thuyết Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học (hay, chi tiết)
Lý thuyết Hóa học 9 Bài 25: Tính chất của phi kim
I. Phi kim có những tính chất vật lí nào ?
Ở điều kiện thường: Phi kim có thể tồn tại ở trạng thái rắn như C, S, P, Si, I2,...; trạng thái lỏng như: Br2; trạng thái khí như: O2, H2, N2, …
Phần lớn phi kim không dẫn điện, dẫn nhiệt và có nhiệt độ nóng chảy thấp.
Một số phi kim độc như clo, brom, iot.
II. Phi kim có những tính chất hóa học nào ?
1. Tác dụng với kim loại
- Oxi tác dụng với kim loại tạo thành oxit
Ví dụ:
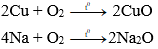
- Các phi kim khác tác dụng với kim loại tạo thành muối
Ví dụ:
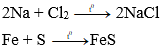
2. Tác dụng với hiđro
- Oxi tác dụng với hiđro tạo thành hơi nước
Phương trình hóa học:
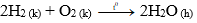
- Các phi kim khác (như C; S; Cl2; Br2…) tác dụng với hiđro tạo thành hợp chất khí
Ví dụ:
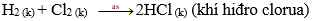
Khí hiđro clorua tan trong nước tạo thành hydrochloric acid và làm quỳ tím hóa đỏ.
3. Tác dụng với oxi
Nhiều phi kim tác dụng với oxi tạo thành acidic oxide
Ví dụ:
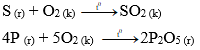
4. Mức độ hoạt động của phi kim
Mức độ hoạt động mạnh hay yếu của phi kim thường được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với kim loại và hiđro.
Các phi kim như flo, oxi, clo là những phi kim hoạt động hóa học mạnh, trong đó flo là phi kim mạnh nhất. Lưu huỳnh, photpho, cacbon, silic là những phi kim hoạt động yếu hơn.
Lý thuyết Hóa học 9 Bài 26: Clo
I. TÍNH CHẤT VẬT LÍ
Clo là chất khí , màu vàng lục, mùi hắc, nặng gấp 2,5 lần không khí 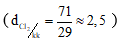
Tác dụng sinh lí: Clo là một khí độc.
II. TÍNH CHẤT HÓA HỌC
1. Clo có những tính chất hóa học của phi kim
a) Tác dụng kim loại → muối clorua
Clo phản ứng với với hầu hết kim loại tạo thành muối clorua
Ví dụ:
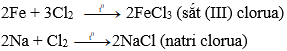
b) Tác dụng hiđro → khí hiđro clorua
Phương trình hóa học:
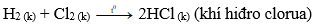
Khí hiđro clorua tan nhiều trong nước tạo thành dung dịch hydrochloric acid.
Chú ý: Clo không phản ứng trực tiếp với oxi.
2. Tính chất hóa học khác của clo
a) Tác dụng với nước
Phương trình hóa học:
Cl2 (k) + H2O (l) ⇄ HCl (dd) + HClO (dd)
Nước clo là dung dịch hỗn hợp các chất Cl2, HCl, HClO có màu vàng lục, mùi hắc.
Khi cho quỳ tím vào nước clo, lúc đầu dung dịch làm quỳ tím hóa đỏ, sau đó nhanh chóng mất màu do tác dụng oxi hóa mạnh của hypochlorous acid HClO.
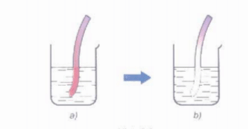
Hình 1: Minh họa cho quỳ tím vào nước clo
Nước clo có tính tẩy màu, sát trùng.
b) Tác dụng với dung dịch kiềm (NaOH, KOH, …)
Ví dụ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Nước Gia - ven là hỗn hợp hai muối sodium chloride (NaCl) và natri hipoclorit (NaClO). Dung dịch này có tính tẩy màu tương tự nước clo.
III. ỨNG DỤNG CỦA CLO
- Nước clo dùng khử trùng nước sinh hoạt.
- Tẩy trắng vải sợi, bột giấy....
- Điều chế nước Gia - ven, clorua vôi...
- Điều chế nhựa PVC, chất dẻo, chất màu...
IV. ĐIỀU CHẾ KHÍ CLO
1. Trong phòng thí nghiệm
Phương pháp: Đun nóng nhẹ dung dịch HCl đậm đặc với các chất oxi hóa mạnh như MnO2, KMnO4,...
Ví dụ:
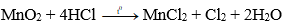
Thu khí clo bằng cách đẩy không khí.

Hình 2: Điều chế clo trong phòng thí nghiệm
2. Trong công nghiệp
Phương pháp: Điện phân dung dịch NaCl bão hòa (có màng ngăn xốp ngăn không cho khí Cl2 thoát ra tác dụng với NaOH tạo thành nước Gia-ven)

Hình 3: Sản xuất clo trong công nghiệp
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm các bài hệ thống kiến thức môn Hóa học lớp 9 hay, chi tiết khác:
- Tổng hợp lý thuyết Các loại hợp chất vô cơ (hay, chi tiết)
- Tổng hợp lý thuyết Kim loại (hay, chi tiết)
- Tổng hợp lý thuyết Hydrocarbon; Nhiên liệu (hay, chi tiết)
- Tổng hợp lý thuyết Dẫn xuất của hydrocarbon; polymer (hay, chi tiết)
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

