Cách nhận biết dung dịch muối nitrate nhanh nhất
Cách nhận biết dung dịch muối nitrate
Bài tập nhận biết thường là nỗi lo lắng với nhiều học sinh.Để làm tốt bài tập nhận biết em cần nắm rõ các phản ứng đặc trưng của từng chất. Bài viết dưới đây sẽ hướng dẫn em cách nhận biết các muối nitrate (hay gốc NO3- ) nói chung và cácmuối nitrate thường gặp như NaNO3; Ba(NO3)2; Mg(NO3)2; Fe(NO3)2; Fe(NO3)3; Cu(NO3)2; Al(NO3)3; Pb(NO3)2; AgNO3; NH4NO3....
I. Cách nhận biết muối nitrate
- Thuốc thử đặc trưng nhận biết ion nitrate (NO3- ) là dung dịch H2SO4 loãng và ít vụn đồng. Phản ứng tạo khí không màu, hóa nâu đỏ trong không khí, dung dịch có màu xanh lơ.
+ Tổng quát: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
+ Hiện tượng: Bột Cu tan ra tạo thành dung dịch màu xanh, khí NO không màu bay lên gặp oxi trong không khí, tạo thành khí NO2 có màu nâu đỏ
2NO + O2 → 2NO2
+ Các phương trình hóa học minh họa:
3Cu + 4H2SO4 + 8NaNO3→ 3Cu(NO3)2 + 4H2O + 4Na2SO4 + 2NO↑
3Cu + 4H2SO4 + 8KNO3→ 3Cu(NO3)2 + 4H2O + 4K2SO4 + 2NO↑
- Nếu các dung dịch đem nhận biết đều là muối nitrate, ta cần dựa vào phản ứng đặc trưng của cation trong dung dịch để nhận biết.
+ Nếu là cation của kim loại trung bình yếu (Mg, Fe, Cu, Al,...) hay NH4+ thì dùng dung dịch kiềm (NaOH, KOH, Ca(OH)2, Ba(OH)2….).
Phản ứng tạo kết tủa hiđroxit có màu đặc trưng với từng cation kim loại, hoặc khí NH3.
Fe(NO3)3 + 3NaOH → 3NaNO3 + Fe(OH)3 (↓nâu đỏ)
Mg(NO3)2 + 2NaOH → 2NaNO3 + Mg(OH)2 ( ↓ trắng)
NH4NO3 + NaOH → NaNO3 + NH3 ↑ + H2O
+ Nếu là cation kim loại mạnh (Ba, Ca) thì dùng dung dịch Na2CO3 (tạo tủa trắng), riêng muối Ba2+ thì có thể dùng dung dịch gốc sunfat.
Ca(NO3)2 + Na2CO3 → CaCO3(↓trắng) + 2NaNO3
Ba(NO3)2 + Na2SO4 → BaSO4( ↓ trắng) + 2NaNO3
+ Nếu kim loại kiềm thì nhận biết bằng cách nhiệt phân.Muối nitrate kim loại Na, K hay được nhận biết sau cùng.
2NaNO3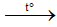 2NaNO2 + O2↑
2NaNO2 + O2↑
Chú ý:
- Nếu đề bài cho phân biệt các dung dịch gồm: axit; bazơ và muối clorua mà không giới hạn thuốc thử có thể dùng quỳ tím để phân biệt.
II. Mở rộng
- Nhiệt phân muối nitrate kim loại.
Muối nitrate đứng trước Mg nhiệt phân tạo muối nitrite và O2↑
2KNO3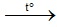 2KNO2 + O2 ↑
2KNO2 + O2 ↑
Muối nitrate của kim loại từ Mg→Cu nhiệt phân tạo oxit kim loại, NO2(nâu đỏ), O2
2Cu(NO3)2 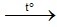 2CuO + 4NO2↑+ O2 ↑
2CuO + 4NO2↑+ O2 ↑
Muối đứng sau Cu nhiệt phân ra kim loại, NO2, O2
2AgNO3 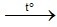 2Ag + 2NO2↑ + O2↑
2Ag + 2NO2↑ + O2↑
- Một số hiđroxit cần nhớ:
+ NaOH, Ba(OH)2; KOH …: Bazơ tan
+ Al(OH)3, Zn(OH)2: Kết tủa keo trắng, tan hết trong dung dịch kiềm dư.
+ Fe(OH)2: Kết tủa trắng xanh.
+ Fe(OH)3: Kết tủa nâu đỏ.
+ Cu(OH)2: Kết tủa xanh lam
+ Mg(OH)2: Kết tủa trắng.
III. Bài tập nhận biết muối nitrate
Câu 1: Cho các dung dịch sau: Na2CO3, NH4NO3, NaNO3, phenolphtalein. Chỉ dùng một hóa chất nào sau đây để phân biệt được tất cả dung dịch trên:
A.BaCl2 B.Ba(OH)2 C. HCl D.Tất cả đều sai
Hướng dẫn giải
Đáp án B
A. Sử dụng dung dịch BaCl2 làm thuốc thử thì ta chỉ nhận biết được dung dịch Na2CO3 do có phản ứng với dung dịch BaCl2 tạo kết tủa trắng:
BaCl2 + Na2CO3 → BaCO3↓+ 2NaCl
B. Sử dụng dung dịch Ba(OH)2 làm thuốc thử thì ta nhận biết được các chất như sau:
+ Dung dịch phản ứng với thuốc thử làm xuất hiện kết tủa trắng là Na2CO3:
Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH
+ Dung dịch phản ứng với thuốc thử giải phóng khí mùi khai là NH4NO3:
2NH4NO3 +Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
+ Dung dịch mà khi cho thuốc thử vào chuyển sang màu hồng là phenolphatlein.
+ Dung dịch mà khi cho thuốc thử vào không có hiện tượng là NaNO3.
C. Sử dụng dung dịch HCl làm thuốc thử thì ta chỉ nhận biết được dung dịch Na2CO3 do khi tác dụng với dung dịch HCl giải phóng khí không màu:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O.
Câu 2: Có 8 dung dịch chứa: NaNO3; Mg(NO3)2; Fe(NO3)2; Cu(NO3)2, Na2SO4, MgSO4, FeSO4, CuSO4. Hãy nêu 2 thuốc thử cần để nhận biết 8 dung dịch trên?
A. NaOH, NaCl
B. HCl, NaCl
C. NaOH, BaCl2
D. HCl, NaOH
Hướng dẫn giải
Đáp án C.
Trích mẫu thử đánh thứ tự từ 1 đến 8, cho dung dịch BaCl2 vào các mẫu thử
- Nhóm 1: Tạo kết tủa trắng thì chất ban đầu là Na2SO4, MgSO4, FeSO4, CuSO4
Ba2+ + SO42- → BaSO4↓
- Nhóm 2: Không có kết tủa thì chất ban đầu làNaNO3; Mg(NO3)2; Fe(NO3)2; Cu(NO3)2
- Cho NaOH vào nhóm 1.
+ Trường hợp tạo kết tủa trắng thì chất ban đầu là MgSO4
MgSO4 + 2NaOH → Mg(OH)2↓+ Na2SO4
+ Trường hợp tạo kết tủa trắng xanh hóa nâu đỏ trong không khí thì chất ban đầu làFeSO4
FeSO4 + 2NaOH → Fe(OH)2↓+ Na2SO4
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 ↓ (nâu đỏ)
+ Trường hợp tạo kết tủa màu xanh lam làCuSO4
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4
+ Trường hợp không có hiện tượng nào xảy ra là Na2SO4.
- Cho NaOH vào nhóm 2, hiện tượng tương tự như nhóm 1
+ Trường hợp tạo kết tủa trắng thì chất ban đầu là Mg(NO3)2
Mg(NO3)2 + 2NaOH → Mg(OH)2↓+ 2NaNO3
+ Trường hợp tạo kết tủa trắng xanh hóa nâu đỏ trong không khí thì chất ban đầu làFe(NO3)2
Fe(NO3)2 + 2NaOH → Fe(OH)2↓+ 2NaNO3
+ Trường hợp tạo kết tủa màu xanh lam làCu(NO3)2
Cu(NO3)2 + NaOH → Cu(OH)2↓+ 2NaNO3
+ Trường hợp không có hiện tượng nào xảy ra là NaNO3.
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



