Cách nhận biết khí hiđro clorua (HCl) nhanh nhất
Hiđro clorua (HCl) là khí không màu, mùi xốc, nặng hơn không khí và tan nhiều trong nước tạo thành dung dịch hydrochloric acid. Bài viết sau đây, sẽ cung cấp cho các em cách nhận biết khí này.
Cách nhận biết khí hiđro clorua (HCl)
I. Cách nhận biết hiđroclorua
- Cách nhận biết: Dùng quỳ tím ẩm
- Hiện tượng: Quỳ tím ẩm chuyển sang màu đỏ.
Ngoài ra, có thể nhận biết khí hiđro clorua bằng cách sục khí vào dung dịch AgNO3, xuất hiện kết tủa màu trắng.
AgNO3 + HCl → AgCl↓ + HNO3
II. Mở rộng
- Trong phòng thí nghiệm, có thể điều chế khíhiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit H2SO4 đậm đặc và đun nóng (phương pháp sunfat). Sau đó, hấp thụ vào nước để thu được dung dịch hydrochloric acid.
NaCl + H2SO4 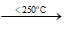 NaHSO4 + HCl ↑
NaHSO4 + HCl ↑
Ở nhiệt độ cao hơn tạo ra Na2SO4 và khí HCl:
2NaCl + H2SO4 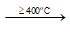 Na2SO4 + 2HCl ↑
Na2SO4 + 2HCl ↑
- Trong công nghiệp, người ta đốt khí H2 trong khí quyển Cl2 (Cl2 và H2 đều là sản phẩm của quá trình điện phân dung dịch NaCl có màng ngăn.
H2 + Cl2 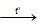 2HCl
2HCl
III. Bài tập nhận biết khí hiđro clorua
Bài 1: Phân biệt các khí sau bằng phương pháp hóa học: Cl2, HCl, NH3.
Hướng dẫn giải:
- Dùng quỳ tím ẩm để phân biệt các khí, hiện tượng thu được:
+ Quỳ tím chuyển sang màu đỏ: HCl
+ Quỳ tím chuyển sang màu đỏ, sau đó mất màu: Cl2
Cl2 + H2O ⇄ HCl + HClO
(HClO có tính tẩy màu nên làm mất màu quỳ tím)
+ Quỳ tím chuyển sang màu xanh: NH3
NH3 + H2O ⇄ NH4+ + OH-
→ Dung dịch có môi trường bazơ nên làm quỳ tím chuyển sang màu xanh.
Bài 2: Để phân biệt hai khí HCl và SO2 cần dùng thuốc thử:
A. Quỳ tím ẩm
B. Dung dịch KOH
C. Dung dịch Ba(OH)2
D. Dung dịch phenolphtalein
Hướng dẫn giải:
Thuốc thử cần dùng là dung dịch Ba(OH)2, hiện tượng:
+ Xuất hiện kết tủa trắng: SO2
SO2 + Ba(OH)2 → BaSO3↓ + H2O
Nếu SO2 sục dư, kết tủa tan dần:
SO2 + BaSO3 + H2O → Ba(HSO3)2
+ Không hiện tượng: HCl
2HCl + Ba(OH)2 → BaCl2 + 2H2O
Chú ý: HCl có phản ứng với Ba(OH)2 nhưng không cho hiện tượng có thể quan sát được.
→ Đáp án C.
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



