Cách nhận biết oxit quan trọng, thường gặp nhanh nhất
Cách nhận biết oxit quan trọng, thường gặp nhanh nhất
1. Nhận biết FeO
iron (II) oxide có công thức hóa học là FeO. FeO là một basic oxide. Bài viết sau đây, cung cấp cho các em cách nhận biết oxit này trong dạng bài tập nhận biết. Các em hãy đọc ngay để nắm được cách nhận biết nhé.
I. Cách nhận biết FeO
- Đặc điểm: FeO là chất rắn, màu đen và không tan trong nước.

- Cách nhận biết: Hòa tan FeO trong HCl.
- Hiện tượng: Chất rắn màu đen tan ra, dung dịch có màu lục nhạt.
- Phương trình hóa học:
FeO + 2HCl → FeCl2 + H2O
Ngoài ra, khi cho FeO tác dụng với H2SO4 đặc, HNO3 thì sinh ra khí:
2FeO + 4H2SO4đặc → Fe2(SO4)3 + SO2 ↑ + 4H2O
3FeO + 10HNO3 → 3Fe(NO3)3 + NO ↑ + 5H2O
II. Mở rộng
FeO là hợp chất không có trong tự nhiên và có thể điều chế bằng cách dùng H2 hay CO khử Fe2O3 ở 500 °C :
Fe2O3 + CO 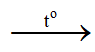 2FeO + CO2↑
2FeO + CO2↑
III. Bài tập nhận biết FeO
Bài 1: Phân biệt hai chất rắn màu đen sau: FeO và CuS? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Phân biệt hai chất rắn FeO và CuS bằng dung dịch axit HCl, hiện tượng thu được:
+ Chất rắn màu đen tan ra: FeO
FeO + 2HCl → FeCl2 + H2O
+ Chất rắn không tan: CuS.
Bài 2: Chỉ dùng một thuốc thử, hãy phân biệt 4 gói chất rắn có màu tương tự nhau sau: FeO, CuO, MnO2 và hỗn hợp (Fe + FeO)? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Lấy mẫu thử và đánh số thứ tự tương ứng.
- Nhỏ thêm dung dịch HCl vào các mẫu thử, đun nóng hiện tượng:
+ Chất rắn tan ra, có khí màu vàng lục thoát ra: MnO2
MnO2 + 4HCl 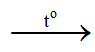 MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
+ Chất rắn tan ra, có khí không màu thoát ra, dung dịch có màu xanh lục: hỗn hợp Fe + FeO
Fe + 2HCl → FeCl2 + H2↑
FeO + 2HCl → FeCl2 + H2O
+ Chất rắn tan ra, dung dịch có màu lục nhạt, không có khí thoát ra: FeO
FeO + 2HCl → FeCl2 + H2O
+ Chất rắn tan ra, dung dịch có màu xanh đậm hơn: CuO
CuO + 2HCl → CuCl2 + H2O
2. Nhận biết Fe2O3
Sắt(III) oxit có công thức là Fe2O3, đây là một trong các hợp chất quan trọng của sắt. Fe2O3 có nhiều trong quặng hematit - nguồn cung cấp sắt cho ngành công nghiệp gang, thép. Bài viết sau đây, sẽ giúp các em biết cách nhận biết Fe2O3 trong bài tập nhận biết.
I. Cách nhận biết Fe2O3
Fe2O3 là chất rắn, có màu nâu đỏ và không tan trong nước.

- Cách nhận biết: Hòa tan Fe2O3 trong dung dịch HCl.
- Hiện tượng: Chất rắn tan ra, dung dịch có màu vàng nâu.
- Phương trình hóa học:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
II. Mở rộng
- Sắt(III) oxit có thể được điều chế bằng phản ứng phân hủy Fe(OH)3 ở nhiệt độ cao:
2Fe(OH)3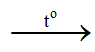 Fe2O3 + 3H2O
Fe2O3 + 3H2O
- Sắt(III) oxit có trong tự nhiên dưới dạng quặng hematit dùng để luyện gang.
III. Bài tập minh họa
Bài 1: Chỉ dùng một thuốc thử, hãy phân biệt 2 gói chất rắn sau: Fe2O3 và hỗn hợp (Fe + Fe2O3)? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Trích mẫu thử.
- Cho lần lượt từng mẫu thử tác dụng với lượng dư HCl
+ Mẫu thử tan dần, thu được dung dịch có màu vàng nâu, không có khí thoát ra → mẫu thử là Fe2O3.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
+ Mẫu thử tan dần, kèm theo có khí thoát ra → mẫu thử là hỗn hợp (Fe; Fe2O3)
Fe + 2HCl → FeCl2 + H2↑
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Bài 2: Có một lượng nhỏ bột sắt(III) oxit bị lẫn tạp chất là vụn sắt. Trình bày cách tách vụn sắt ra khỏi mẫu để thu được sắt(III) oxit tinh khiết.
Hướng dẫn giải:
Sắt bị nam châm hút, còn sắt(III) oxit không bị nam châm hút. Do đó có thể sử dụng nam châm để hút vụn sắt ra khỏi mẫu để được sắt(III) oxit tinh khiết.
3. Nhận biết CaO
Canxi oxit có công thức hóa học là CaO hay thường được gọi vôi sống. Canxi oxit thuộc loại basic oxide. Hằng năm, trên thế giới sản xuất hàng trăm triệu tấn CaO. Điều này cho thấy ứng dụng của CaO rất rộng rãi. Vậy CaO có những ứng dụng gì? Nhận biết CaO trong các bài tập nhận biết ra sao? Để có câu trả lời, các em hãy đọc ngay bài viết sau đây.
I. Cách nhận biết CaO
- Đặc điểm: CaO là chất rắn, màu trắng, tan trong nước.

- Cách nhận biết: Hòa tan chất rắn vào nước, sau đó cho tiếp mẩu quỳ tím vào hỗn hợp sau phản ứng.
- Hiện tượng: Phản ứng tỏa nhiệt, sinh ra chất rắn màu trắng ít tan trong nước. Phần dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh.
- Phương trình hóa học:
CaO + H2O → Ca(OH)2(phản ứng vôi tôi)
- Chú ý:
* Nếu cho nhận biết hỗn hợp oxit, trong đó có CaO và oxit của kim loại kiềm thì dung dịch thu được sau khi hòa tan oxit vào nước, ta sục thêm khí CO2 hoặc SO2.
+ Xuất hiện kết tủa trắng: Ca(OH)2 hay chất ban đầu là CaO
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + SO2 → CaSO3↓ + H2O
+ Không hiện tượng: hiđroxit của kim loại kiềm hay chất ban đầu là oxit của kim loại kiềm.
* CaO tác dụng với dung dịch axit HCl, phản ứng tỏa nhiệt.
CaO + 2HCl → CaCl2 + H2O
II. Mở rộng
- CaO là một trong những loại nguyên liệu trong ngành xây dựng, công nghiệp sản xuất gạch silicat, thủy tinh, gốm.
- Ngoài ra, canxi oxit còn được dùng để khử chua đất trồng trọt, xử lý nước thải công nghiêp, sát trùng, diệt nấm, khử độc môi trường,…
III. Bài tập nhận biết CaO
Bài 1: Bằng phương pháp hóa học nào có thể nhận biết hai chất rắn màu trắng CaO và Na2O? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Lấy mẫu thử vào ống nghiệm và đánh số thứ tự tương ứng.
- Nhỏ vài ml nước vào các ống nghiệm và lắc đều:
+ Chất rắn tan hoàn toàn, dung dịch trong suốt: Na2O
Na2O + H2O → 2NaOH
+ Chất rắn tan, sinh ra chất màu trắng ít tan trong nước: CaO
CaO + H2O → Ca(OH)2
Lưu ý: Ca(OH)2 là chất ít tan trong nước. Phần tan trong nước gọi là dung dịch nước vôi trong.
Bài 2: Hãy nhận biết hai chất rắn màu trắng sau: CaO, CaCO3 bằng phương pháp hóa học? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Lấy mẫu thử vào các ống nghiệm và đánh số tương ứng.
- Nhỏ vài giọt dung dịch HCl vào các ống nghiệm, hiện tượng:
+ Chất rắn tan ra, có khí bay lên: CaCO3
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
+ Chất rắn tan ra, phản ứng tỏa nhiệt.
CaO + 2HCl → CaCl2 + H2O
4. Nhận biết BaO
Barium oxide có công thức là BaO được sử dụng nhiều trong ngành gốm sứ và khai khoáng. Bài viết dưới đây, giúp các em nắm được phương pháp nhận biết oxit này và ứng dụng của nó.
I. Cách nhận biết BaO
- BaO là chất rắn, màu trắng, tan trong nước.

- Cách nhận biết: Hòa tan chất rắn vào nước, sau đó cho thêm một mẩu quỳ tím vào dung dịch sau phản ứng.
- Hiện tượng: Chất rắn tan hoàn toàn trong nước, tỏa nhiệt mạnh, quỳ tím chuyển sang màu xanh.
- Phương trình hóa học:
BaO + H2O → Ba(OH)2
Ngoài ra, ta có thể dùng dung dịch axit H2SO4 để nhận biết. Phản ứng sinh ra kết tủa trắng.
BaO + H2SO4 → BaSO4↓ + H2O
Chú ý: CaO tác dụng với dung dịch H2SO4 cũng sinh ra kết tủa trắng.
CaO + H2SO4 → CaSO4↓ + H2O.
→ Để phân biệt CaO và BaO thì chúng ta phân biệt bằng nước:
+ BaO toàn hoàn toàn trong nước dư, tạo dung dịch trong suốt.
+ CaO tan trong nước nhưng sản phẩm sinh ra Ca(OH)2 ít tan trong nước nên chúng ta sẽ quan sát được chất rắn màu trắng.
II. Mở rộng
- barium oxide là chất được dùng nhiều trong ngành gốm sứ, khai khoáng:
+ Trong ngành gốm sứ, BaO được sử dụng làm chất trợ chảy. Nó có thể kết hợp với một số oxit khác tạo ra màu độc đáo như màu ngọc lam khi kết hợp với đồng.
+ BaO được dùng làm khô xăng và dung môi.
- Lưu ý: BaO là chất có hại cho da và nếu nuốt phải một lượng lớn sẽ gây kích ứng thậm chí gây tử vong.
III. Bài tập nhận biết BaO
Bài 1: Hãy trình bày phương pháp hóa học phân biệt 2 chất rắn màu trắng sau: BaO và Na2O?
Hướng dẫn giải:
- Lấy mẫu thử vào các ống nghiệm và đánh số tương ứng.
- Nhỏ từng giọt dung dịch axit H2SO4 đến dư vào các ống nghiệm:
+ Chất rắn tan tạo thành dung dịch đồng nhất: Na2O
Na2O + H2SO4 → Na2SO4 + H2O
+ Sau phản ứng vẫn có kết tủa trắng: BaO
BaO + H2SO4 → BaSO4↓ + H2O
Bài 2: Cho các chất rắn sau: CuO, BaO, Fe2O3, ZnO. Hãy trình bày phương pháp phân biệt các chất rắn trên?
Hướng dẫn giải:
- Chất rắn màu đen: CuO
- Chất rắn màu nâu đỏ: Fe2O3
- Chất rắn màu trắng: BaO, ZnO
- Lần lượt cho hai chất rắn còn lại vào ống nghiệm chứa nước và lắc đều:
+ Chất rắn tan tạo dung dịch trong suốt: BaO
BaO + H2O → Ba(OH)2
+ Chất rắn không tan: ZnO
5. Nhận biết Fe3O4
Hợp chất của sắt với oxi có công thức là Fe3O4 gọi là oxit sắt từ. Oxit sắt này gặp trong phòng thí nghiệm dưới dạng bột màu đen. Cách nhận biết oxit sắt từ như thế nào? Bài viết sau sẽ giúp các em làm rõ điều này.
I. Cách nhận biết Fe3O4
Sắt từ oxit không tan trong nước.

- Cách nhận biết: Dùng dung dịch axit HCl
- Hiện tượng: Chất rắn tan, dung dịch có màu vàng nâu
- Phương trình hóa học:
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Ngoài ra, khi tác dụng với H2SO4 đặc (hoặc HNO3) có khí thoát ra.
10H2SO4đặc + 2Fe3O4 → 3Fe2(SO4)3 + SO2↑ + 10H2O
28HNO3loãng + 3Fe3O4 → 9Fe(NO3)3 + NO↑ + 14H2O
Fe3O4 + 10HNO3đặc → 3Fe(NO3)3 + NO2↑ + 5H2O
II. Mở rộng
- Trong tự nhiên, Fe3O4 có nhiều trong quặng manhetit. Quặng manhetit có hàm lượng sắt cao nhất nhưng lại hiếm.
- Fe3O4 dạng hạt nano được dùng để đánh dấu tế bào và xử lí nước bị nhiễm bẩn.
III. Bài tập nhận biết Fe3O4
Bài 1:Có thể dùng một hóa chất để phân biệt Fe2O3 và Fe3O4. Hóa chất này là
A. dung dịch HCl loãng.
B. dung dịch HCl đặc.
C. dung dịch H2SO4 loãng.
D. dung dịch HNO3 đặc.
Hướng dẫn giải:
- Dùng dung dịch HNO3 đặc để phân biệt, hiện tượng:
+ Chất rắn tan ra: Fe2O3
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
+ Chất rắn tan ra và có khí thoát ra: Fe3O4
Fe3O4 + 10HNO3 → 3Fe(NO3)3 + NO2↑ + 5H2O
Đáp án D
Bài 2: Chỉ dùng một thuốc thử để nhận biết các chất rắn có màu tương tự nhau sau: Fe3O4, CuO, CuS, Ag2O? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Lấy mẫu thử và đánh số tương ứng.
- Cho thêm dung dịch HCl vào các mẫu thử, hiện tượng:
+ Chất rắn tan ra, dung dịch có màu vàng nâu: Fe3O4
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
+ Chất rắn tan ra, dung dịch có màu xanh: CuO
CuO + 2HCl → CuCl2 + H2O
+ Chất rắn tan ra, xuất hiện kết tủa màu trắng: Ag2O
Ag2O + 2HCl → 2AgCl↓ + H2O
+ Chất rắn không tan: CuS.
6. Nhận biết CuO
Copper (II) oxide có công thức hóa học là CuO. Chất này được sử dụng nhiều trong ngành công nghiệp gốm sứ. Bài viết dưới đây, giúp các em biết cách nhận biết được oxit này nhanh nhất.
I. Cách nhận biết CuO
- CuO là chất rắn, dạng bột, màu đen, không tan trong nước.

- Cách nhận biết:
* Cách 1: Cho bột CuO vào dung dịch axit như HCl, H2SO4 ....
Hiện tượng: Bột CuO tan ra và dung dịch có màu xanh
Phương trình hóa học:
CuO + H2SO4 → CuSO4 + H2O
* Cách 2: Dẫn khí H2 (hoặc CO) qua CuO đun nóng.
Hiện tượng: Chất rắn màu đen chuyển dần sang màu đỏ.
Phương trình hóa học:
H2 + CuO đen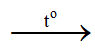 Cu đỏ+ H2O
Cu đỏ+ H2O
CO + CuOđen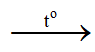 Cu đỏ+ CO2↑
Cu đỏ+ CO2↑
II. Mở rộng
CuO được ứng dụng trong sản xuất gốm, thủy tinh, đồ sứ. Do CuO không bị oxi hóa trong không khí ở nhiệt độ thường, không bị biến đổi màu, bay màu nên được sử dụng làm chất tạo màu sắc trong nghề gốm, thủy tinh, đồ sứ tạo sản phẩm có màu xanh lá trong lớp men.
III. Bài tập nhận biết CuO
Bài 1: Hãy trình bày phương pháp phân biệt hai chất rắn màu đen sau: CuO và CuS? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Lấy mẫu thử và đánh số thứ tự tương ứng.
- Nhỏ từng giọt dung dịch HCl đến dư vào các mẫu thử, hiện tượng:
+ Chất rắn tan, dung dịch có màu xanh: CuO
CuO + 2HCl → CuCl2 + H2O
+ Chất rắn không tan: CuS
Bài 2: Cho một mẫu bột Cu kim loại có lẫn tạp một ít tạp chất là bột CuO, trình bày phương pháp hóa học để thu được bột Cu tinh khiết.
Hướng dẫn giải:
Cho hỗn hợp vào lượng dư dung dịch HCl.
CuO phản ứng, tan vào dung dịch, còn lại Cu không phản ứng. Tiến hành lọc, rửa ta thu được Cu tinh khiết.
CuO + 2HCl → CuCl2 + H2O
Cu + HCl → không phản ứng.
7. Nhận biết Al2O3
Nhôm oxit có công thức là Al2O3 còn được gọi là alumin (bắt nguồn từ tiếng Pháp). Nó còn được biết đến với tên là alumina trong ngành khai khoáng, gốm sứ và khoa học vật liệu. Bài viết dưới đây, sẽ giúp các em nắm được cách nhận biết Al2O3 khi làm dạng bài tập nhận biết.
I. Cách nhận biết Al2O3
- Al2O3 là chất rắn dạng bột hoặc hạt màu trắng và không tan nước nhưng tan được dung dịch kiềm.

- Cách nhận biết: Có thể dùng dung dịch axit (như HCl, H2SO4 …) hoặc dung dịch kiềm (như NaOH, KOH, Ba(OH)2 …).
- Hiện tượng: Al2O3 tan được trong cả dung dịch axit và dung dịch kiềm.
- Phương trình hóa học minh họa:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
2NaOH + Al2O3 → 2NaAlO2 + H2O
- Giải thích: Al2O3 là oxit lưỡng tính nên vừa tác dụng với dung dịch axit và kiềm.
II. Mở rộng
- Al2O3 là thành phần chính của quặng boxit.
- Trong tự nhiên, nhôm oxit tồn tại dưới dạng ngậm nước và dạng khan.
+ Dạng oxit ngậm nước là thành phần chủ yếu của quặng boxit (Al2O3.2H2O) dùng để sản xuất nhôm.
+ Dạng oxit khan, có cấu tạo tinh thể là đá quý. Dạng này ít phổ biến và thường gặp là:
Corindon ở dạng tinh thể trong suốt, không màu, rất rắn, được dùng để chế tạo đá mài, giấy nhám,…
Trong tinh thể Al2O3, nếu một số ion Al3+ được thay bằng ion Cr3+ ta có hồng ngọc dùng làm đồ trang sức, chân kính đồng hồ và dùng trong kĩ thuật laze.
Tinh thể Al2O3 có lẫn tạp chất Fe2+, Fe3+ và Ti4+ ta có saphia dùng làm đồ trang sức.
Bột nhôm oxit dùng trong công nghiệp sản xuất chất xúc tác cho tổng hợp hữu cơ.
III. Bài tập nhận biết Al2O3
Bài 1: Có ba oxit màu trắng: MgO, Al2O3, Na2O. Có thể nhận biết các chất đó bằng thuốc thử:
A. Chỉ dùng axit
B. Chỉ dùng phenolphtalein
C. Dùng nước
D. Chỉ dùng quỳ tím.
Hướng dẫn giải:
Đáp án C
- Lấy mẫu thử và đánh số tương ứng.
- Hòa tan 3 chất rắn vào nước, hiện tượng:
+ Chất rắn tan trong nước tạo thành dung dịch: Na2O
Na2O + H2O → 2NaOH
+ Chất rắn không tan trong nước: Al2O3, MgO.
- Cho các mẫu thử còn lại lần lượt vào dung NaOH ở trên, hiện tượng:
+ Chất rắn tan: Al2O3
Al2O3 + 2NaOH → 2NaAlO2 + H2O
+ Không hiện tượng: MgO
Bài 2: Chỉ dùng nước hãy trình bày phương pháp nhận biết các chất rắn sau: BaO, BaCO3, Al2O3?
Hướng dẫn giải:
- Lấy mẫu thử và đánh số tương ứng.
- Hòa tan 3 chất rắn vào nước, hiện tượng:
+ Chất rắn tan trong nước tạo thành dung dịch: BaO
BaO + H2O → Ba(OH)2
+ Chất rắn không tan: BaCO3 và Al2O3
- Dùng chính dung dịch Ba(OH)2 ở trên nhỏ vào các ống nghiệm còn lại:
+ Chất rắn tan: Al2O3
Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O
+ Chất rắn không tan: BaCO3
8. Nhận biết ZnO
Zinc oxide có công thức là ZnO, đây là oxit lưỡng tính nên tác dụng được cả với dung dịch axit và dung dịch bazơ. Cách nhận biết oxit này như thế nào? ZnO có những ứng dụng nào? Để có đáp án cho câu hỏi trên, các em không thể bỏ qua bài viết dưới đây.
I. Cách nhận biết ZnO
Ở nhiệt độ thường, ZnO có dạng bột, màu trắng mịn, không màu, không mùi và không tan trong nước.

- Cách nhận biết: Sử dụng dung dịch axit (như HCl, H2SO4…) hoặc dung dịch kiềm (như NaOH, KOH, Ba(OH)2 …).
- Hiện tượng: ZnO tan được trong cả dung dịch axit và dung dịch kiềm tạo thành dung dịch không màu.
- Phương trình hóa học:
ZnO + 2HCl → ZnCl2 + H2O
2NaOH + ZnO → Na2ZnO2 + H2O
- Giải thích: ZnO là oxit lưỡng tính nên vừa tác dụng với dung dịch axit và kiềm.
Lưu ý: Khi nung ZnO lên trên 300°C nó sẽ bị chuyển sang màu đen và trở lại màu trắng khi được làm lạnh.
II. Mở rộng
Zinc oxide được ứng dụng rộng rãi trong các ngành mỹ phẩm, y tế và xây dựng:
+ Các sản phẩm như kem chống nắng và thuốc mỡ chứa ZnO để bảo vệ da khỏi bị cháy nắng. Ngoài ra, zinc oxide cũng có trong các sản phẩm dầu gội trị gàu, trị nấm da đầu,… hay trong các sản phẩm rôm, sẩy cho bé.
+ zinc oxide được ứng dụng khá nhiều trong y tế, đặc biệt là trong nha khoa. Hỗn hợp eugenol với zinc oxide được coi như là xi măng trong nha khoa. Nó là một vật liệu không thể thiếu trong trám răng, hàn răng, …
+ Kẽm oxit được dùng trong quá trình sản xuất bê tông, nó giúp cải thiện thời gian xử lý và làm bê tông chống thấm nước tốt hơn. Ngoài ra,kẽm oxit cũng được dùng trong ngành sơn, làm lớp phủ chống ăn mòn kim loại.
III. Bài tập nhận biết ZnO
Bài 1: Chỉ dùng nước hãy phân biệt các chất rắn màu trắng sau: ZnO, Na2O, CaCO3? Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Lấy mẫu thử vào các ống nghiệm và đánh số thứ tự tương ứng.
- Cho nước vào các ống nghiệm và lắc đều:
+ Chất rắn tan và tạo dung dịch trong suốt: Na2O
Na2O + H2O → 2NaOH
+ Chất rắn không tan: ZnO và CaCO3
- Nhỏ dung dịch NaOH ở trên nhỏ vào các ống nghiệm còn lại:
+ Chất rắn tan: ZnO
ZnO + 2NaOH → Na2ZnO2 + H2O
+ Chất rắn không tan: CaCO3
Bài 2: Có các chất rắn màu trắng sau: BaO, ZnO, Na2O và P2O5 đựng trong các bình riêng biệt mất nhãn. Hãy trình bày phương pháp nhận biết 4 chất trên. Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Lấy mẫu thử vào các ống nghiệm và đánh số thứ tự tương ứng:
- Cho thêm nước và mẩu quỳ tím vào các ống nghiệm, lắc đều:
+ Chất rắn không tan, quỳ tím không đổi màu: ZnO
+ Chất rắn tan, quỳ tím đổi thành màu đỏ: P2O5
P2O5 + 3H2O → 2H3PO4
+ Chất rắn tan, quỳ tím đổi thành màu xanh: BaO, Na2O (nhóm I)
BaO + H2O → Ba(OH)2
Na2O + H2O → 2NaOH
- Nhỏ vài giọt dung dịch H2SO4 vào các dung dịch khi hòa tan các chất nhóm I trong nước:
+ Xuất hiện kết tủa trắng: Ba(OH)2 hay chất ban đầu là BaO
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
+ Không hiện tượng: NaOH hay chất ban đầu là Na2O
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



