Công thức hidroxit cao nhất của nhóm VIIA
Bài viết công thức hidroxit cao nhất của nhóm VIIA (hay công thức hydroxide cao nhất của nhóm VIIA) có đầy đủ nội dung về công thức hidroxit cao nhất, kiến thức mở rộng và bài tập vận dụng về hidroxit cao nhất của nhóm VIIA. Mời các bạn theo dõi:
Công thức hidroxit cao nhất của nhóm VIIA
I. Công thức hidroxit cao nhất của nhóm VIIA
Công thức hydroxide cao nhất của nhóm VIIA là: HRO4 (với R là nguyên tố nhóm VIIA).
Giải thích:
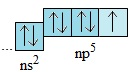
Cấu hình electron chung của nhóm VIIA là: ns2np5.
⇒ Có hoá trị cao nhất trong hợp chất hydroxide là VII. Ta có:
R(OH)7 ↔ H7RO7 ↔ HRO4.3H2O
Do đó, công thức hydroxide cao nhất của nhóm VIIA là: HRO4
II. Mở rộng kiến thức
1. Vị trí nhóm VIIA trong bảng tuần hoàn
- Nhóm VIIA (hay nhóm halogen) gồm các nguyên tố fluorine (F); chlorine (Cl); bromine (Br), iodine (I), astatine (At) và tennessine (Ts). Trong đó At và Ts không gặp trong tự nhiên, nó được điều chế nhân tạo trong các lò phản ứng hạt nhân nên được xem xét chủ yếu ở nhóm các nguyên tố phóng xạ.
- Những nguyên tố nhóm halogen đứng ở cuối chu kì, ngay trước các nguyên tố khí hiếm.
2. Cấu hình electron nguyên tử và cấu tạo phân tử
- Lớp electron ngoài cùng của nguyên tử các nguyên tố halogen đều có 7 electron được phân thành hai phân lớp: phân lớp s có 2 electron; phân lớp p có 5 electron.
⇒ Cấu hình electron lớp ngoài cùng của nguyên tử các halogen là: ns2np5.
- Do có 7 electron ở lớp ngoài cùng, nên ở trạng thái tự do hai nguyên tử halogen ghép chung 1 đôi electron để tạo thành phân tử có liên kết cộng hóa trị không cực:
Hay X – X hay X2 (X là kí hiệu chỉ các nguyên tố halogen).
- Liên kết của phân tử X2 không bền lắm, chúng dễ tách thành 2 nguyên tử X. Trong các phản ứng hóa học, các nguyên tử này rất hoạt động vì chúng dễ nhận thêm một electron để đạt cấu hình bền vững của khí hiếm.
X + 1e → X- (X: F , Cl , Br , I)
⇒ Tính chất hóa học cơ bản của các halogen là tính oxi hóa mạnh.
3. Sự biến đổi tính chất
Đi từ fluorine đến iodine ta thấy:
- Trạng thái tập hợp: Từ thể khí chuyển sang thể lỏng và thể rắn.
- Màu sắc: Đậm dần.
- Nhiệt độ nóng chảy và nhiệt độ sôi: Tăng dần.
- Độ âm điện giảm dần. Độ âm điện của các nguyên tố nhóm halogen tương đối lớn.
- Fluorine có độ âm điện lớn nhất nên trong tất cả các hợp chất chỉ có số oxi hóa là -1. Các nguyên tố halogen khác, ngoài số oxi hóa -1 còn có các số oxi hóa +1; +3; +5; +7.
- Vì lớp electron ngoài cùng có cấu tạo tương tự nhau (ns2np5) nên các đơn chất halogen giống nhau về tính chất hóa học cũng như thành phần và tính chất của các hợp chất do chúng tạo thành.
- Halogen là các phi kim điển hình. Đi từ F đến I tính oxi hóa giảm dần.
III. Bài tập vận dụng liên quan
Câu 1: X là nguyên tố nhóm VIIA. Công thức hydroxide ứng với hóa trị cao nhất của X là
A. X(OH)3.
B. H2XO4.
C. HXO4.
D. HXO3.
Hướng dẫn giải:
Đáp án C
X thuộc nhóm VIIA nên công thức hydroxide cao nhất sẽ là HXO4.
Câu 2: Hydroxide cao nhất của một nguyên tố có dạng HRO4. Biết R cho hợp chất khí với hydrogen chứa 2,74%H theo khối lượng. Nguyên tố R là
A. P.
B. I.
C. Cl.
D. Br.
Hướng dẫn giải:
Đáp ánC
Hydroxide cao nhất của một nguyên tố có dạng HRO4
Þ R thuộc nhóm VIIA.
Công thức hợp chất khí với hydrogen của R là RH.
%mH = 2,74% =
mR = 35,5 (g/mol) R là Cl.
Câu 3: R là nguyên tố nhóm VIIA. Trong công thức hydroxide cao nhất tương ứng R chiếm 55,17% về khối lượng. R là
A. HClO4.
B. HIO4.
C. HNO3.
D. HBrO4.
Hướng dẫn giải:
Đáp án D
Vì R thuộc nhóm VIIA⇒ công thức hydroxide cao nhất của R là HRO4
⇒ R = 80 ⇒ R là Br.
Xem thêm Công thức hidroxit cao nhất hay, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)

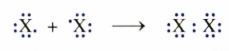





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



