Công thức định luật Faraday (hay, chi tiết)
Công thức định luật Faraday (hay, chi tiết)
Công thức định luật Faraday Vật Lí lớp 11 sẽ giúp học sinh nắm vững công thức, từ đó có kế hoạch ôn tập hiệu quả để đạt kết quả cao trong các bài thi Vật Lí 11.
Bài viết Công thức định luật Faraday hay nhất gồm 4 phần: Định nghĩa, Công thức - Đơn vị đo, Mở rộng và Bài tập minh họa áp dụng công thức trong bài có lời giải chi tiết giúp học sinh dễ học, dễ nhớ Công thức định luật Faraday Vật Lí 11.
1. Định nghĩa
Hiện tượng dương cực tan xảy ra khi các anion đi tới anôt kéo các ion kim loại của điện cực vào trong dung dịch.
Ví dụ: Xét trường hơp bình điện phân đựng dung dịch CuSO4 với cực dương bằng đồng:
Khi có dòng điện chạy qua, cation Cu2+ chạy về catôt và nhận electron trở thành nguyên tử Cu bám vào điện cực.
Cu2+ + 2e- → Cu
Ở anôt, electron bị kéo về cực dương của nguồn điện, tạo điều kiện hình thành ion Cu2+ trên bề mặt tiếp xúc với dung dịch.
Cu → Cu2+ + 2e-
Khi anion (SO4)2- chạy về anôt, nó kéo ion Cu2+ vào dung dịch. Như vậy, đồng ở anôt sẽ tan dần vào trong dung dịch. Đó là hiện tượng dương cực tan.
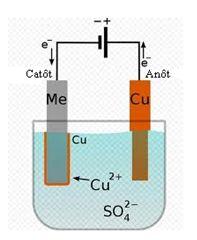
Khi xảy ra hiện tượng dương cực tan, dòng điện trong chất điện phân tải điện lượng cùng với vật chất (theo nghĩa hẹp) nên khối lượng chất đi đến điện cực:
+ Tỉ lệ thuận với điện lượng chạy qua bình điện phân;
+ Tỉ lệ thuận với khối lượng của ion (hay khối lượng mol nguyên tử A của nguyên tố tạo nên ion ấy);
+ tỉ lệ nghịch với điện tích của ion (hay hóa trị n của nguyên tố tạo ra ion ấy)
* Định luật Fa-ra-đây thứ nhất
Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó.
* Định luật Fa-ra-đây thứ hai
Đương lượng điện hoá k của một nguyên tố tỉ lệ với đương lượng gam 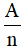 của nguyên tố đó. Hệ số tỉ lệ là
của nguyên tố đó. Hệ số tỉ lệ là  , trong đó F gọi là số Fa-ra-đây.
, trong đó F gọi là số Fa-ra-đây.
2. Công thức – đơn vị đo
* Định luật Fa-ra-đây thứ nhất
Khối lượng vật chất được giải phóng ở điện cực của bình điện phân tỉ lệ thuận với điện lượng chạy qua bình đó.
m = k.q
Trong đó:
+ k gọi là đương lượng điện hoá của chất được giải phóng ở điện cực;
+ q là điện lượng chạy qua bình điện phân, có đơn vị Culong;
+ m là khối lượng vật chất được giải phóng ở điện cực của bình điện phân, có đơn vị gam (g).
* Định luật Fa-ra-đây thứ hai
Đương lượng điện hoá k của một nguyên tố tỉ lệ với đương lượng gam 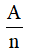 của nguyên tố đó. Hệ số tỉ lệ là
của nguyên tố đó. Hệ số tỉ lệ là 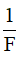 , trong đó F gọi là số Fa-ra-đây.
, trong đó F gọi là số Fa-ra-đây.
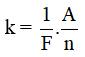
Trong đó:
+ k là đương lượng điện hóa.
+ F là số Fa-ra-đây, F = 96494 C/mol, thường lấy chắn là F = 96500 C/mol.
+ A là khối lượng mol nguyên tử của nguyên tố tạo nên ion, có đơn vị gam.
+ n là hóa trị của nguyên tố tạo ra ion.
* Kết hợp hai định luật Fa-ra-đây, ta được công thức Fa-ra-đây:
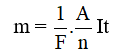
Trong đó:
+ m là chất được giải phóng ở điện cực, tính bằng gam.
+ F là số Fa-ra-đây, F = 96494 C/mol, thường lấy chắn là F = 96500 C/mol.
+ A là khối lượng mol nguyên tử của nguyên tố tạo nên ion, có đơn vị gam.
+ n là hóa trị của nguyên tố tạo ra ion.
+ I là cường độ dòng điện chạy qua bình điện phân, có đơn vị ampe (A);
+ t là thời gian dòng điện chạy qua bình điện phân, có đơn vị giây (s).
3. Mở rộng
Khối lượng vật chất giải phóng ở điện cực dương cũng bằng khối lượng vật chất bám vào cực âm.
Từ công thức định luật Fa-ra-đây, ta có thể suy ra các đại lượng cường độ dòng điện, thời gian điện phân, khối lượng mol nguyên tử (từ đó xác định tên nguyên tố).
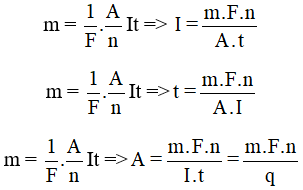

4. Bài tập minh họa
Bài 1: Một bình điện phân đựng dung dịch AgNO3 có điện trở là 2,5 Ω. Anốt của bình điện phân bằng bạc (Ag) và hiệu điện thế đặt vào hai điện cực của bình là 10V. Tính khối lượng m của bạc bám vào catốt sau 16 phút 5 giây. Khối lượng nguyên tử của bạc là A=108 và hóa trị n = 1.
Bài giải:
Đổi 16 phút 5 giây = 965 giây
Cường độ dòng điện chạy qua bình điện phân là: 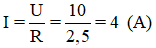
Khối lượng bạc bám vào catốt sau 16 phút 5 giây là:
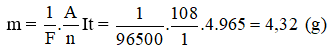
Đáp án: 4,32 g
Bài 2: Người ta muốn bóc một lớp đồng dày d = 10μm trên một bản đồng diện tích S = 1cm2 bằng phương pháp điện phân. Cường độ dòng điện là 0,010 A. Tính thời gian cần thiết để bóc được lớp đồng. Cho biết đồng có khối lượng riêng là D = 8900 kg/m3, khối lượng mol 64 g/mol và hóa trị 2.
Bài giải:
Khối lượng đồng phải bóc đi:
m = D.V = D.S.d = 8900.1.10-4.10.10-6 = 8,9.10-6 (kg) = 8,9.10-3 (g)
Áp dụng công thức định luật Faraday:
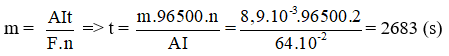
Đáp án: 2683 giây
5. Bài tập tự luyện
Câu 1: Đương lượng điện hóa của niken là . Một điện lượng 5 C chạy qua bình điện phân có anôt bằng niken thì khối lượng của niken bám vào catốt là
A. 6.10-3 g
B. 6.10-4 g
C. 1,5.10-3 g
D. 1,5.10-4 g
Câu 2: Cho dòng điện chạy qua bình điện phân đựng dung dịch muối của niken, có anôt làm bằng niken, biết nguyên tử khối và hóa trị của niken lần lượt bằng 58,71 và 2. Trong thời gian 1h dòng điện 10A đã sản ra một khối lượng niken bằng:
A. 8.10-3kg.
B. 10,95 (g).
C. 12,35 (g).
D. 15,27 (g).
Câu 5: Đương lượng điện hóa của đồng là . Muốn cho trên catốt của bình điện phân chứa dung dịch CuSO4, với cực dương bằng đồng xuất hiện 1,65 g đồng thì điện lượng chạy qua bình điện phân phải là
A. 5.103 C
B. 5.104 C
C. 5.105 C
D. 5.106 C
Câu 6: Điện phân cực dương tan một dung dịch trong 20 phút thì khối lượng cực âm tăng thêm 4 gam. Nếu điện phân trong một giờ với cùng cường độ dòng điện như trước thì khối lượng cực âm tăng thêm là
A. 24 gam.
B. 12 gam.
C. 6 gam.
D. 48 gam.
Câu 7: Một bình điện phân chưa dung dịch AgNO3 có điện trở 2 Ω. Anốt của bình bằng bạc và hiệu điện thế đặt vào hai cực của bình điện phân là 12 V. Biết bạc có A = 108 g/mol, có n = 1. Khối lượng bạc bám vào catốt của bình điện phân sau 16’5s là
A. 4,32 mg
B. 4,32 g
C. 6,48 g
D. 8,64 g
Câu 8: Khi điện phân dung dịch AgNO3 với cực dương là Ag biết khối lượng mol của bạc là 108. Cường độ dòng điện chạy qua bình điện phân để trong 1 h để có 27 gam Ag bám ở cực âm là
A. 6,7 A
B. 3,35 A
C. 24124 A
D. 108 A
Câu 9: Để giải phóng lượng clo và hiđrô từ 7,6g axit clohiđric bằng dòng điện 5A, thì phải cần thời gian điện phân là bao lâu? Biết rằng đương lượng điện hóa của hiđrô và clo lần lượt là: và
A. 1,5 h
B. 1,3 h
C. 1,2 h
D. 1,0 h
Câu 10: Hai bình điện phân (FeCl3/Fe và CuSO4/Cu) mắc nối tiếp. Sau một khoảng thời gian, bình thứ nhất giải phóng một lượng sắt là 1,4 g. Biết khối lượng mol của đồng và sắt là 64 và 56, hóa trị của đồng và sắt là 2 và 3. Tính lượng đồng giải phóng ở bình thứ hai trong cùng khoảng thời gian đó
A. 2,4 g
B. 2,6 g
C. 2,8 g
D. 3,2 g
Câu 11: Hai bình điện phân: (CuSO4/Cu và AgNO3/Ag) mắc nối tiếp, trong một mạch điện có cường độ 0,5 A. Sau thời gian điện phân t, tổng khối lượng catôt của hai bình tăng lên 5,6 g. Biết khối lượng mol của đồng và bạc và 64 và 108, hóa trị của đồng và bạc là 2 và 1. Tính t?
A. 2h28’40s
B. 7720’
C. 2h8’40s
D. 8720’
Câu 12: Cực âm của một bình điện phân dương cực tan có dạng một lá mỏng. Khi dòng điện chạy qua bình điện phân trong 1 h thì cực âm dày thêm 1mm. Để cực âm dày thêm 2 mm nữa thì phải tiếp tục điện phân cùng điều kiện như trước trong thời gian là
A. 1 h.
B. 2 h.
C. 3 h.
D. 4 h.
Xem thêm các Công thức Vật Lí lớp 11 quan trọng hay khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

