Top 33 Đề thi Hóa học lớp 8 học kì 2 có đáp án
Top 33 Đề thi Hóa học lớp 8 học kì 2 có đáp án
Dưới đây là danh sách Top 33 Đề thi Hóa học lớp 8 học kì 2 có đáp án, cực sát đề thi chính thức gồm các đề kiểm tra 15 phút, 1 tiết, Đề thi Giữa kì, đề thi học kì. Hi vọng bộ đề thi này sẽ giúp bạn ôn tập & đạt điểm cao trong các bài thi Hóa học 8.
A/ Đề thi Hóa học 8 theo PPCT
B/ Đề thi Hóa học 8 theo Chương
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 1)
Câu 1: Thế nào là dung dịch, dung dịch chưa bão hòa, dung dịch bão hòa? Hãy dẫn ra những thí dụ để minh họa.
Câu 2: Cho biết ở nhiệt độ phòng thí nghiệm khoảng 20ºC, 10 gam nước có thể hòa tan tối đa 20 gam đường; 3,6 gam muối ăn.
a) Em hãy dẫn ra những thí dụ về khối lượng của đường, muối ăn để tạo ra những dung dịch chưa bão hòa với 10 gam nước.
b) Em có nhận xét gì nếu người ta khuấy 25 gam đường vào 10 gam nước; 3,5 gam muối ăn vào 10 gam nước (nhiệt độ phòng thí nghiệm)?
Câu 3: Em hãy mô tả cách tiến hành những thí nghiệm sau:
a) Chuuyển đổi từ một dung dịch NaCl bão hòa thành một dung dịch chưa bão hòa (ở nhiệt độ phòng).
b) Chuyển đổi từ một dung dịch NaCl chưa bão hòa thành một dung dịch bão hòa (ở nhiệt độ phòng).
Đáp án và hướng dẫn giải
Câu 1:
- Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan.
- Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
- Dung dịch bão hòa là dung dịch không có thể hòa tan thêm chất tan.
Thí dụ: cho dần dần đường vào cốc nước, khuấy nhẹ, đều.
Nhận xét: Giai đoạn đầu đường tan trong nước tạo thành nước đường; nước đường là dung dịch, và vẫn có thể hòa tan thêm đường gọi là dung dịch chưa bão hòa. Giai đoạn sau, ta thu được nước đường nhưng không thể hòa tan thêm đường gọi là dung dịch đã bão hòa (nhận biết bằng cách lọc qua giấy lọc, có những tinh thể đường không tan).
Câu 2:
a) Để tạo ra dung dịch chưa bão hòa với 10 gam nước thì hòa tan một lượng chưa đến 20 gam đường hoặc chưa đến 3,6 gam muối ăn.
b) Người ta khuấy 25 gam đường vào 10 gam nước sẽ thu được dung dịch nước đường bão hòa; còn 3,5 gam muối ăn vào 10 gam nước sẽ thu được dung dịch muối ăn chưa bão hòa.
Câu 3:
a) Pha thêm dung môi (nước) vào dung dịch NaCl bão hòa thì thu được dung dịch NaCl chưa bão hòa.
b) Cho thêm chất tan (NaCl) vào dung dịch NaCl chưa bão hòa thành dung dịch NaCl bão hòa.
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 2)
Câu 1: Xác định độ tan của muối Na2CO3 trong nước ở 18ºC. Biết rằng ở nhiệt độ này khi hòa tan hết 53 gam Na2CO3 trong 250 gam nước thì được dung dịch bão hòa.
Câu 2: Độ tan của FeBr2.6H2O ở 20ºC là 115 gam. Xác định khối lượng FeBr2.6H2O có trong 516 gam dung dịch bão hòa ở nhiệt độ trên.
Đáp án và hướng dẫn giải
Câu 1: Độ tan của muối Na2CO3 ở 18ºC là: S = (53 x 100)/250 = 21,2 (gam).
Câu 2: Trong 215 gam dung dịch FeBr2.6H2O bão hòa ở 20ºC chứa 115 gam FeBr2.6H2O.
516 gam dung dịch FeBr2.6H2O bão hòa ở 20ºC chưa x gam FeBr2.6H2O.
x = 516x115/215 = 276 (gam)
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 3)
Câu 1: Độ tan là gì?
Câu 2: Tìm độ tan của một muối trong nước bằng phương pháp thực nghiệm, người ta có được những kết quả sau:
- Nhiệt độ của dung dịch muối bão hòa là 20ºC.
- Chén sứ nung có khối lượng 60,26 gam.
- Chén sử đứng dung dịch muối có khối lượng 86,26 gam.
- Khối lượng chén nung và muối kết tinh sau khi làm bay hết hơi nước là 66,26 gam.
Hãy xác định độ tan của muối ở nhiệt độ 20ºC.
Đáp án và hướng dẫn giải
Câu 1: Độ tan của một chất là số gam chất đó tan được trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
Câu 2: Ta có: mdd = 86,26 – 60,26 = 26 (gam)
mct = 66,26 – 60,26 = 6 (gam)
mH2O= mdd – mct = 26 – 6 = 20 (gam)
Ở 20ºC, cứ 20 gam nước hòa tan 6 gam muối tạo dung dịch bão hòa.
Vậy ở 20ºC, 100 gam nước hòa tan khối lượng muối là:
S = 100x6/20 = 30 (gam)
Vậy độ tan của muối ở 20ºC là 30 gam.
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 4)
Câu 1: Nồng độ phần trăm là gì? Viết công thức tính nồng độ phần trăm.
Câu 2: Nồng độ mol là gì? Viết công thức tính nồng độ mol.
Câu 3: Biết SK2SO4 (20°C) = 11,1 gam. Hãy tính nồng độ phần trăm của dung dịch K2SO4 bão hòa ở nhiệt độ này.
Đáp án và hướng dẫn giải
Câu 1: Nồng độ phần trăm (kí hiệu C%) của một dung dịch cho ta biết số gam chất tan có trong 100 gam dung dịch.
Công thức: 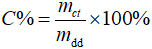
Trong đó: mct: khối lượng chất tan (gam); mdd: khối lượng dung dịch (gam).
Câu 2: Nồng độ mol (kí hiệu CM) của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
Công thức: CM = n/V (M hay mol/l)
Trong đó: n: số mol chất tan (mol); V: thể tích dung dịch (lít).
Câu 3: SK2SO4 (20°C) = 11,1 gam hay ở 20ºC, cứ 100 gam nước hòa tan 11,1 gam K2SO4 tạo ra dung dịch bão hòa.
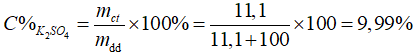
Phòng Giáo dục và Đào tạo .....
Đề kiểm tra 15 phút Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 15 phút
(Đề 5)
Câu 1: Làm bay hơi 60 gam nước từ dung dịch có nồng độ 15%, được dung dịch mới có nồng độ 18%. Hãy xác định khối lượngc ủa dung dịch ban đầu.
Câu 2: Cân lấy 10,6 gam Na2CO3 cho vào cốc chia độ có dung tích 500ml. Rót từ từ nước cất vào cốc cho đến vạch 200ml. Khuấy nhẹ cho Na2CO3 tan hết, ta được dung dịch Na2CO3. Biết 1ml dung dịch này cho khối lượng là 1,05 gam. Hãy xác định nồng độ phần trăm (C%) và nồng độ mol của dung dịch vừa pha chế được.
Đáp án và hướng dẫn giải
Câu 1: Gọi x là khối lượng dung dịch ban đầu thì khối lượng dung dịch sau khi làm bay hơi: x – 60.
Khối lượng chất tan trong dung dịch ban đầu:
mct = (C%.mdd)/(100%)= (15%.x)/(100%)= 0,15x
Khối lượng chất tan trong dung dịch sau khi làm bay hơi:
mct = (C%.mdd)/(100%)= (18%(x-60))/(100%)= 0,18(x – 60)
Mà khối lượng chất tan trước và sau khi bay hơi không đổi (vì chỉ làm bay hơi nước) nên ta có:
0,15x = 0,18(x – 60) → x = 360 gam.
Câu 2: 1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng mdd = 210 gam
Nồng độ phần trăm:
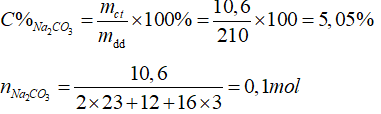
CM(Na2CO3) = 0,1: 0,2 = 0,5M.
Đề kiểm tra 1 tiết
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 1)
Câu 1: Một muối sunfat của kim loại hóa trị II ngậm nước có phân tử khối 278 gam và khối lượng nước kết tinh chiếm 45,324%. Tìm công thức hóa học của muối trên.
Câu 2: Cho các cụm từ sau: dung dịch bão hòa, dung dịch chưa bão hòa, dung môi, chất tan, độ tan, hiđrat. Hãy chọn từ hay cụm từ điền vào chỗ trống trong các câu sau cho phù hợp:
Ở nhiệt độ xác định, số gam chất tan có thể tan trong 100 gam nước để tạo thành __(1)__ được gọi là __(2)__ của chất.
Những hợp chất được tạo nên do phân tử chất tan kết hợp với phân tử nước gọi là các __(3)__.
Dung dịch là hỗn hợp đồng chất của __(4)__ và __(5)__.
Dung dịch không thể hòa tan thêm __(6)__ ở nhiệt độ xác định gọi là __(7)__.
Câu 3: Hòa tan 36,5 gam HCl vào nước, thu được 500ml dung dịch có khối lượng riêng D = 1,1 g/ml. Tính nồng độ mol và nồng độ phần trăm của dung dịch thu được.
Câu 4: Cho 20,55 gam Ba vào cốc đựng 79,75 gam H2O, xảy ra phản ứng:
Ba + 2H2O → Ba(OH)2 + H2↑
Xác định nồng độ phần trăm của dung dịch thu được.
Đáp án và hướng dẫn giải
Câu 1: Gọi công thức muối ngậm nước có dạng: RSO4.nH2O
Theo đề bài ta có hệ phương trình:
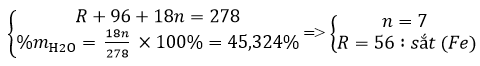
Vậy công thức của muối sắt là: FeSO4.7H2O
Câu 2:
Ở nhiệt độ xác định, số gam chất tan có thể tan trong 100 gam nước để tạo thành dung dịch bão hòa được gọi là độ tan của chất.
Những hợp chất được tạo nên do phân tử chất tan kết hợp với phân tử nước gọi là các hiđrat.
Dung dịch là hỗn hợp đồng chất của chất tan và dung môi.
Dung dịch không thể hòa tan thêm chất tan ở nhiệt độ xác định gọi là dung dịch bão hòa.
Câu 3: Ta có: nHCl = 36,5/36,5 = 1 (mol)
mdung dịch = 500 x 1,1 = 550 (gam)
→ CMHCl = 1/0,5= 2M;
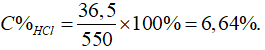
Câu 4: Ta có: nBa = 20,55/137= 0,15 (mol)
Ba + 2H2O → Ba(OH)2 + H2↑ (1)
(mol) 0,15 0,15 0,15
Từ (1) → mH2= 0,15 x 2 = 0,3 (gam)
Khối lượng dung dịch thu được là:
mdd = mBa - mH2= 20,55 + 79,75 – 0,3 = 100 (gam)
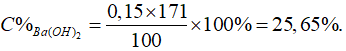
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 2)
Câu 1: hãy tính nồng độ mol của mỗi dung dịch sau:
a) 1 mol KCl trong 750ml dung dịch.
b) 0,5 mol MgCl2 trong 1,5 lít dung dịch.
c) 400 gam CuSO4 trong 4 lít dung dịch.
d) 0,06 mol Na2CO3 trong 1500 ml dung dịch.
Câu 2: Đem cô cạn 200ml dung dịch FeSO4 0,5M thì khối lượng muối khan thu được là bao nhiêu?
Câu 3: Trộn 200ml dung dịch H2SO4 2,5M với 100ml dung dịch H2SO4 1M. Tính nồng độ của dung dịch H2SO4 thu được sau khi trộn.
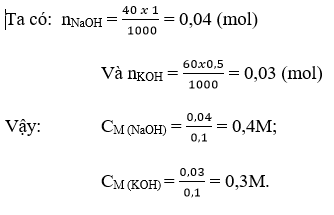
Câu 4: Cho 40ml dung dịch NaOH 1M vào 60ml dung dịch KOH 0,5M. Xác định nồng độ mol của NaOH và KOH sau khi trộn.
Đáp án và hướng dẫn giải
Câu 1:
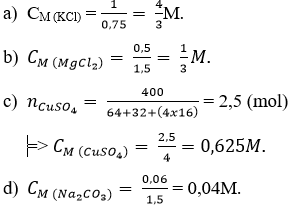
Câu 2: Ta có: nFeSO4= 0,2 x 0,5 = 0,1 (mol)
→ mFeSO4= 0,1 x 152 = 15,2 (gam)
Câu 3: Ta có: nH2SO4= 0,2 x 2,5 + 0,1 x 1 = 0,6 (mol)
→ CM sau khi trộn = 0,6/0,3 = 2M.
Câu 4:
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 3)
Câu 1: Đun nhẹ 20 gam dung dịch CuSO4 cho đến khi nước bay hơi hết, người ta thu được chất rắn màu trắng là CuSO4 khan. Chất này có khối lượng là 3,6 gam. Hãy xác định nồng độ phần trăm của dung dịch CuSO4 ban đầu.
Câu 2: Cân lấy 10,6 gam Na2CO3 cho vào cốc chia độ có dung tích 500ml. Rót từ từ nước cất vào cốc cho đến vạch 200ml. Khuấy nhẹ cho Na2CO3 tan hết, ta được dung dịch Na2CO3. Biết 1ml dung dịch này cho khối lượng là 1,05 gam. Hãy xác định nồng độ phần trăm (C%) và nồng độ mol của dung dịch vừa pha chế được.
Câu 3: Hãy trình bày cách pha chế:
a) 400 gam dung dịch CuSO4 4%.
b) 300ml dung dịch NaCl 3M.
Đáp án và hướng dẫn giải
Câu 1:Nồng độ phần trăm của dung dịch CuSO4:
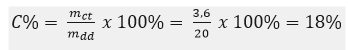
Câu 2: 1ml dung dịch cho khối lượng 1,05 gam
200 ml dung dịch cho khối lượng mdd = 210 gam
Nồng độ phần trăm:
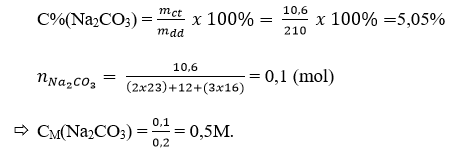
Câu 3: Khối lượng của CuSO4:
mCuSO4=(4% x 400)/(100%) = 16 (gam)
Khối lượng dung môi:
mdm = mdd – mct = 400 – 16 = 384 (gam)
* Cách pha chế: Cân lấy 16 gam CuSO4 khan (màu trắng) cho vào cốc. Cân lấy 384 gam (hoặc đong lấy 384ml) nước cất, rồi đổ dần dần vào cốc rồi khuấy nhẹ cho tan hết. Ta thu được 400 gam dung dịch CuSO4 4%.
b) Số mol của NaCl :
nNaCl = 3 x 0,3 = 0,9 (mol)
Khối lượng của NaCl:
mNaCl = 0,9 x 58,5 = 52,65 (gam).
* Cách pha chế: Cần lấy 52,65 gam NaCl cho vào cốc thủy tinh có dung tích 500ml. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 300 ml dung dịch. Ta được 300ml dung dịch NaCl 3M.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
Môn: Hóa Học lớp 8
Thời gian làm bài: 45 phút
(Đề 4)
Câu 1: Hãy trình bày cách pha chế 150 gam dung dịch CuSO4 2% từ dung dịch CuSO4 20%.
Câu 2: Cho 150ml dung dịch H2SO4 22,44% (D = 1,31g/ml). Tính số mol của H2SO4 có trong dung dịch trên.
Câu 3: Ở 30ºC, hòa tan 75 gam muối CuSO4.5H2O vào 300 gam nước thì thu được dung dịch bão hòa. Hãy tính độ tan của muối CuSO4.5H2O ở nhiệt độ đó.
Câu 4: Trong 500ml dung dịch Z có chứa 8,4 gam KOH.
a) Tính nồng độ mol của dung dịch Z.
b) Phải thêm bao nhiêu ml nước vào 500ml dung dịch Z để được dung dịch KOH 0,1M?
Đáp án và hướng dẫn giải
Câu 1: Khối lượng CuSO4 có trong 150 gam dung dịch CuSO4 2% là:
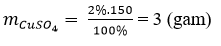
Khối lượng dung dịch H2SO4 20% có chứa 3 gam CuSO4 là:
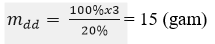
Khối lượng nước cần dùng để pha chế:
mH2O= 150 – 15 = 135 (gam)
* Cách pha chế: Cân lấy 15 gam dung dịch CuSO4 20%, sau đó đổ 135 gam nước vào cốc đựng dung dịch CuSO4 nói trên. Khuấy đều, ra thu được 150 gam dung dịch CuSO4 2%.
Câu 2: Ta có:
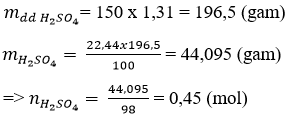
Câu 3: Độ tan của muối CuSO4.5H2O ở 30ºC là:
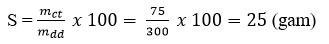
Câu 4:
Tính CMKOH:
Ta có: nKOH = 8,4/56 = 0,15 (mol)
→ CMKOH = 0,15/0,5 = 0,3M.
Tính VH2O phải thêm:
Vì khi pha loãng dung dịch thì số mol chất tan không đổi nên:
nKOH ban đầu = nKOH lúc sau
Gọi V là thể tích dung dịch sau khi pha loãng.
Ta có: V = n/CM = 0,15/0,1 = 1,5 (lít) = 1500 (ml)
Vậy thể tích nước cần thêm vào là:
1500 – 500 = 1000 (ml).
Xem thêm các đề kiểm tra, đề thi Hóa học lớp 8 chọn lọc, có đáp án hay khác:
Tổng hợp Bộ đề thi Hóa học lớp 8 năm 2025 học kì 1 và học kì 2 có đáp án của chúng tôi được biên soạn và sưu tầm từ đề thi môn Hóa học của các trường THCS trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 8 Global Success
- Giải sgk Tiếng Anh 8 Smart World
- Giải sgk Tiếng Anh 8 Friends plus
- Lớp 8 - Kết nối tri thức
- Soạn văn 8 (hay nhất) - KNTT
- Soạn văn 8 (ngắn nhất) KNTT
- Giải sgk Toán 8 - KNTT
- Giải sgk Khoa học tự nhiên 8 - KNTT
- Giải sgk Lịch Sử 8 - KNTT
- Giải sgk Địa Lí 8 - KNTT
- Giải sgk Giáo dục công dân 8 - KNTT
- Giải sgk Tin học 8 - KNTT
- Giải sgk Công nghệ 8 - KNTT
- Giải sgk Hoạt động trải nghiệm 8 - KNTT
- Giải sgk Âm nhạc 8 - KNTT
- Lớp 8 - Chân trời sáng tạo
- Soạn văn 8 (hay nhất) - CTST
- Soạn văn 8 (ngắn nhất) - CTST
- Giải sgk Toán 8 - CTST
- Giải sgk Khoa học tự nhiên 8 - CTST
- Giải sgk Lịch Sử 8 - CTST
- Giải sgk Địa Lí 8 - CTST
- Giải sgk Giáo dục công dân 8 - CTST
- Giải sgk Tin học 8 - CTST
- Giải sgk Công nghệ 8 - CTST
- Giải sgk Hoạt động trải nghiệm 8 - CTST
- Giải sgk Âm nhạc 8 - CTST
- Lớp 8 - Cánh diều
- Soạn văn 8 Cánh diều (hay nhất)
- Soạn văn 8 Cánh diều (ngắn nhất)
- Giải sgk Toán 8 - Cánh diều
- Giải sgk Khoa học tự nhiên 8 - Cánh diều
- Giải sgk Lịch Sử 8 - Cánh diều
- Giải sgk Địa Lí 8 - Cánh diều
- Giải sgk Giáo dục công dân 8 - Cánh diều
- Giải sgk Tin học 8 - Cánh diều
- Giải sgk Công nghệ 8 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 8 - Cánh diều
- Giải sgk Âm nhạc 8 - Cánh diều


 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



