Đề thi Học kì 2 Hóa học lớp 8 có đáp án (6 đề)
Đề thi Học kì 2 Hóa học lớp 8 có đáp án (6 đề)
Với Đề thi Học kì 2 Hóa học lớp 8 có đáp án (6 đề), chọn lọc giúp học sinh ôn tập và đạt kết quả cao trong bài thi Học kì 2 Hóa học 8.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 1)
(Cho nguyên tử khối của: C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Chất nào sau đây không phản ứng với khí oxi?
A. Nước. B. Lưu huỳnh.
C. Khí metan. D. Sắt.
Câu 2: Oxit nào dưới đây không phải là oxit axit?
A. SO2. B. SO3. C. NO. D. P2O5.
Câu 3: Cho các chất sau: H2SO3, KOH, FeCl3, Na2CO3, Ca(OH)2, HNO3, CuSO4. Số axit, bazơ và muối lần lượt là
A. 3, 2, 2. B. 2, 3, 2. C. 2, 2, 3. D. 1, 3, 3.
Câu 4: Phản ứng nào sau đây là phản ứng thế?
A. 3CO + Fe2O3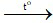 2Fe + 3CO2.
2Fe + 3CO2.
B. Fe + CuCl2 ⟶ FeCl2 + Cu.
C. 2KClO3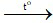 2KCl + 3O2↑.
2KCl + 3O2↑.
D. CaO + CO2 → CaCO3.
Câu 5: Nồng độ phần trăm của một dung dịch cho ta biết
A. số mol chất tan trong một lít dung dịch.
B. số gam chất tan có trong 100 gam dung dịch.
C. số mol chất tan có trong 150 gam dung dịch.
D. số gam chất tan có trong dung dịch.
Câu 6: Phát biểu nào sau đây không đúng?
A. Có chất không tan và có chất tan trong nước.
B. Có chất tan nhiều, có chất tan ít trong nước.
C. Dung dịch là hỗn hợp đồng chất của chất tan và dung môi.
D. Dung môi là chất bị hòa tan trong nước.
Câu 7: Thành phần các chất trong không khí gồm
A. 78% nitơ; 1% oxi; 21% các chất khác.
B. 21% nitơ; 78% oxi; 1% các chất khác.
C. 50% nitơ; 50% oxi.
D. 21% oxi; 78% nitơ; 1% các chất khác.
Câu 8: Khi cho dòng điện một chiều đi qua nước, trên bề mặt 2 điện cực sẽ sinh ra
A. khí hiđro và khí oxi.
B. khí hiđro và khí cacbon oxit.
C. khí oxi và khí cacbon oxit.
D. khí hiđro và khí clo.
Câu 9: Tên gọi của chất có công thức hóa học H2SO4 là
A. axit sunfuric. B. axit sunfurơ.
C. axit sunfuhiđric. D. axit lưu huỳnh.
Câu 10: Cần thêm bao nhiêu ml nước vào 100 ml dung dịch Ca(OH)2 0,5M để thu được dung dịch mới có nồng độ 0,1M?
A. 400 ml. B. 300 ml. C. 200 ml. D. 100 ml.
Câu 11: Hòa tan 15 gam NaCl vào 55 gam nước. Nồng độ phần trăm của dung dịch là
A. 21,43%. B. 26,12%. C. 28,10%. D. 29,18%.
Câu 12: Tại sao người ta dùng phương pháp đẩy nước để thu khí oxi?
A. Oxi mạnh hơn nước.
B. Oxi tan nhiều trong nước.
C. Khối lượng riêng của oxi nặng hơn nước.
D. Oxi ít tan trong nước.
Câu 13: Độ tan của một chất trong nước là
A. số gam chất đó hòa tan trong 1000 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
B. là số gam nước cần dùng để hòa tan 100 gam chất đó.
C. số gam chất đó hòa tan trong 150 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
D. số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
Câu 14: Công thức Fe2O3 có tên gọi là gì?
A. Sắt oxit. B. Sắt (II) oxit.
C. Sắt (III) oxit. D. Sắt từ oxit.
Câu 15: Tỉ lệ khối lượng của các nguyên tố hiđro và oxi trong H2O là
A. 1 : 3. B. 5 : 6. C. 1 : 8. D. 2 : 7.
Câu 16: Chất tan là
A. hỗn hợp đồng nhất của dung môi và chất tan.
B. chất bị hòa tan trong dung môi.
C. chất có khả năng tác dụng với nước.
D. chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Câu 17: Nếu đốt cháy hoàn toàn 2,4 gam cacbon trong 4,8 gam oxi thì thu được tối đa bao nhiêu gam khí CO2?
A. 6,6 gam. B. 6,5 gam. C. 6,4 gam. D. 6,3 gam.
Câu 18: Khử hoàn toàn 24 gam đồng (II) oxit bằng khí hiđro. Khối lượng đồng kim loại thu được là
A. 6,4 gam. B. 12,8 gam. C. 16,0 gam. D. 19,2 gam.
Câu 19: Công thức hóa học của sắt (III) hiđroxit là
A. Fe(OH)2. B. Fe2O3. C. Fe(OH)3. D. FeO.
Câu 20: Trong phản ứng hóa học giữa khí H2 và CuO ở nhiệt độ cao đã xảy ra
A. sự oxi hóa H2 tạo thành H2O.
B. sự khử H2 tạo thành H2O.
C. sự oxi hoá CuO tạo ra Cu.
D. sự phân hủy CuO thành Cu.
Câu 21: Trong 200 ml dung dịch có hòa tan 8,5 gam NaNO3. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
Câu 22: Ở một nhiệt độ xác định, dung dịch bão hòa là dung dịch
A. không thể hòa tan thêm chất tan.
B. có thể hòa tan thêm chất tan.
C. có thể hòa tan nhiều chất tan cùng một lúc.
D. không thể hòa tan nhiều chất tan cùng một lúc.
Câu 23: Trong các chất sau: K2O, P2O5, CaO, Na2O. Nước tác dụng được với chất nào tạo ra axit?
A. P2O5 B. Na2O C. K2O D. CaO
Câu 24: Để dập tắt đám cháy người ta cần
A. Quạt mạnh vào đám cháy
B. Cách li chất cháy với oxi
C. Duy trì nhiệt độ đám cháy
D. Cung cấp thêm oxi
Câu 25: Cho 4,6 gam Na tác dụng với nước dư. Sau phản ứng thu được V lít khí (ở đktc). Giá trị của V là
A. 2,24. B. 1,12. C. 3,36. D. 4,48.
Câu 26: Phát biểu nào sau đây không đúng?
A. Khí hiđro là chất khí không màu, không mùi, không vị.
B. Khí hiđro nhẹ nhất trong các chất khí.
C. Khí hiđro tan nhiều trong nước.
D. Khí hiđro nhẹ hơn không khí.
Câu 27: Cho các phản ứng sau:
1) 2FeCl2 + Cl2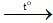 2FeCl3
2FeCl3
2) CuO + H2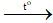 Cu + H2O
Cu + H2O
3) 2KNO3 2KNO2 + O2
2KNO2 + O2
4) 2Fe(OH)3 Fe2O3 + 3H2O
Fe2O3 + 3H2O
5) CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
Số phản ứng phân hủy là
A. 1. B. 2. C. 3. D. 4.
Câu 28: Biết độ tan của AgNO3 ở 25oC là 222 gam. Khối lượng AgNO3 có thể tan trong 150 gam nước ở 25oC là
A. 555 gam. B. 444 gam. C. 333 gam. D. 222 gam.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. A |
2. C |
3. C |
4. B |
5. B |
6. D |
7. D |
8. A |
9. A |
10. A |
11. A |
12. D |
13. D |
14. C |
15. C |
16. B |
17. A |
18. D |
19. C |
20. A |
21. D |
22. A |
23. A |
24. B |
25. A |
25. C |
27. B |
28. C |
Câu 1:
Đáp án A
Nước không phản ứng được với khí oxi.
Khí metan, lưu huỳnh, sắt phản ứng được với khí oxi.
CH4 + 2O2 CO2 + 2H2O
CO2 + 2H2O
S + O2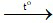 SO2
SO2
3Fe + 2O2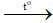 Fe3O4
Fe3O4
Câu 2:
Đáp án C
NO là oxit trung tính.
Câu 3:
Đáp án C
Phân tử axit gồm có một hay nhiều nguyên tử hiđro liên kết với gốc axit, các nguyên tử hiđro này có thể thay thế bằng các nguyên tử kim loại.
⇒ Axit: H2SO3, HNO3.
Phân tử bazơ gồm có một nguyên tử kim loại liên kết với một hay nhiều nhóm hiđroxit (– OH).
⇒ Bazơ: KOH, Ca(OH)2.
Phân tử muối gồm có một hay nhiều nguyên tử kim loại (hoặc ) liên kết với một hay nhiều gốc axit.
⇒ Muối: FeCl3, Na2CO3, CuSO4.
Câu 4:
Đáp án B
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
⇒ Phản ứng thế: Fe + CuCl2 ⟶ FeCl2 + Cu (nguyên tử của đơn chất Fe thay thế nguyên tử nguyên tố Cu trong hợp chất CuCl2).
Câu 5:
Đáp án B
Nồng độ phần trăm (kí hiệu là C%) của một dung dịch cho ta biết số gam chất tan có trong 100 gam dung dịch.
Câu 6:
Đáp án D
Dung môi là chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Câu 7:
Đáp án D
Thành phần không khí bao gồm 21% oxi, 78% nitơ và 1% là các chất khác.
Câu 8:
Đáp án A
Khi cho dòng điện một chiều đi qua nước, trên bề mặt 2 điện cực sẽ sinh ra khí hiđro và khí oxi.
Phương trình hoá học: 2H2O 2H2↑ + O2↑.
2H2↑ + O2↑.
Câu 9:
Đáp án A
H2SO4: axit có nhiều oxi.
⇒ Tên axit: axit + tên của phi kim + ic.
⇒ H2SO4: axit sunfuric.
Câu 10:
Đáp án A
Dung dịch Ca(OH)2 0,5M: 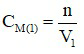 (M).
(M).
Dung dịch Ca(OH)2 0,1M: 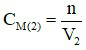 (M).
(M).
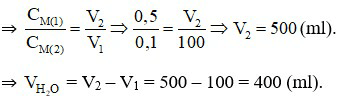
Câu 11:
Đáp án A
mdd = 15 + 55 = 70 (gam).
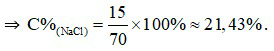
Câu 12:
Đáp án D
Dùng phương pháp đẩy nước để thu khí oxi vì khí oxi ít tan trong nước.
Câu 13:
Đáp án D
Độ tan (kí hiệu là S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
Câu 14:
Đáp án C
Công thức Fe2O3 có tên gọi là sắt (III) oxit.
Câu 15
Đáp án C
Tỉ lệ khối lượng của các nguyên tố hiđro và oxi trong H2O là
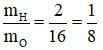
Câu 16:
Đáp án B
Chất tan là chất bị hòa tan trong dung môi.
Câu 17:
Đáp án A
Ta có: 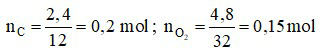
Phương trình hóa học:
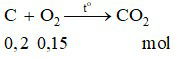
Nhận thấy: 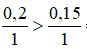 ⇒ C dư, O2 hết.
⇒ C dư, O2 hết.
Câu 18:
Đáp án D
Phương trình hóa học: CuO + H2 Cu + H2O.
Cu + H2O.
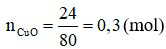
Theo phương trình hóa học: 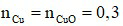 (mol)
(mol)
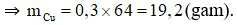
Câu 19:
Đáp án C
Công thức hóa học của sắt (III) hiđroxit là Fe(OH)3.
Câu 20:
Đáp án A
Sự tách oxi khỏi hợp chất gọi là sự khử. Sự tác dụng của oxi với một chất là sự oxi hóa.
Phương trình hóa học: CuO + H2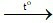 Cu + H2O (1).
Cu + H2O (1).
Trong phản ứng (1) trên đã xảy ra:
Quá trình tách nguyên tử oxi khỏi hợp chất CuO → xảy ra sự khử CuO tạo ra Cu.
Quá trình kết hợp của nguyên tử oxi trong CuO với H2 → sự oxi hóa H2 tạo thành H2O.
Câu 21:
Đáp án D
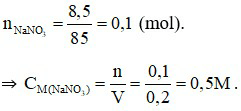
Câu 22:
Đáp án A
Ở một nhiệt độ xác định:
Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan.
Câu 23:
Đáp án A
Nước tác dụng với oxit axit để tạo ra axit tương ứng.
P2O5 là oxit axit.
P2O5 + 3H2O ⟶ 2H3PO4
Câu 24:
Đáp án B
Để dập tắt đám cháy người ta cần cách li chất cháy với khí oxi.
Câu 25:
Đáp án A
Phương trình hoá học: 2Na + 2H2O → 2NaOH + H2↑.
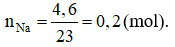
Theo phương trình hoá học: 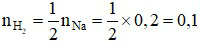 (mol).
(mol).
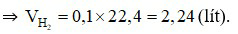
Câu 26:
Đáp án C
C sai vì khí hiđro ít tan trong nước.
Câu 27:
Đáp án B
Phản ứng phân hủy là phản ứng từ một chất bị phân hủy thành hai hay nhiều chất khác.
⇒ Phản ứng phân hủy: (3) và (4).
Câu 28:
Đáp án C
100 gam nước ở 25oC hòa tan tối đa được 222 gam AgNO3.
⇒ 150 gam nước ở 25oC hòa tan tối đa được: 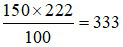 gam AgNO3.
gam AgNO3.

Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 2)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Hợp chất nào sau đây không phải là oxit?
A. CO2. B. SO2. C. CuO. D. CuS.
Câu 2: Phát biểu nào sau đây về oxi là không đúng?
A. Oxi cần thiết cho sự sống.
B. Oxi không có mùi và không có màu.
C. Oxi là một đơn chất phi kim rất hoạt động, nhất là ở nhiệt độ cao.
D. Oxi tan nhiều trong nước.
Câu 3: Biết độ tan của NaCl ở 25oC là 36,2 gam. Khối lượng AgNO3 có thể tan tối đa trong 250 gam nước ở 25oC là
A. 36,2. B. 50,5. C. 62,8. D. 90,5.
Câu 4: Dãy các bazơ nào sau đây là bazơ tan?
A. KOH, NaOH, Ca(OH)2, Ba(OH)2.
B. KOH, NaOH, Cu(OH)2, Mg(OH)2.
C. Al(OH)3, Ca(OH)2, NaOH, Mg(OH)2.
D. Ba(OH)2, KOH, Zn(OH)2, Cu(OH)2.
Câu 5: Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2 Cu + H2O.
Cu + H2O.
B. Mg + 2HCl → MgCl2 + H2.
C. Ca(OH)2 + CO2 CaCO3 + H2O.
CaCO3 + H2O.
D. Zn + CuSO4 → ZnSO4 + Cu.
Câu 6: Tính thể tích (ml) dung dịch HNO3 1M. Biết trong dung dịch có hòa tan 12,6 gam HNO3.
A. 200 ml. B. 220 ml. C. 250 ml. D. 280 ml.
Câu 7: Cho dần dần và liên tục đường vào cốc nước, khuấy nhẹ. Ở giai đoạn đầu, ta được dung dịch đường, dung dịch này vẫn có thể hòa tan thêm đường. Ở giai đoạn sau, ta được một dung dịch đường không thể hòa tan thêm đường gọi là
A. dung dịch đường chưa bão hòa.
B. dung dịch đường trung tính.
C. dung dịch đường bão hòa.
D. dung dịch đường kém bão hòa.
Câu 8: Cho hai thí nghiệm sau:
Thí nghiệm 1: Cho một luồng khí H2 (sau khi đã kiểm tra sự tinh khiết) đi qua bột đồng (II) oxit CuO có màu đen ở nhiệt độ thường.
Thí nghiệm 2: Đốt nóng CuO tới khoảng 400oC rồi cho luồng khí H2 đi qua.
Phát biểu nào sau đây không đúng?
A. Thí nghiệm 1: Không có phản ứng hóa học xảy ra.
B. Thí nghiệm 2: Bột CuO màu đen chuyển dần thành màu đỏ gạch.
C. Không có hiện tượng gì ở cả hai thí nghiệm.
D. Thí nghiệm 2: Có những giọt nước tạo thành.
Câu 9: Dãy hợp chất nào sau đây chỉ gồm các hợp chất axit?
A. NaOH; KCl; HCl. B. HCl; CuSO4; NaOH.
C. HCl; H2SO4; HNO3. D. H2SO4; NaCl; Cu(OH)2.
Câu 10: Chất có khả năng hòa tan chất khác để tạo thành dung dịch được gọi là
A. chất oxi hóa. B. chất khử.
C. dung môi. D. chất tan.
Câu 11: Chọn câu trả lời đúng trong các câu sau đây về thành phần thể tích của không khí.
A. 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, CO, khí hiếm, …)
B. 21% các khí khác, 78% khí nitơ, 1% khí oxi.
C. 21% khí nitơ, 78% khí oxi, 1% các khí khác (CO2, CO, khí hiếm, …)
D. 21% khí oxi, 78% các khí khác, 1% khí nitơ.
Câu 12: Cho phương trình hóa học: 2Al + Fe2O3 Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
A. sự oxi hóa, sự khử.
B. sự khử, sự oxi hóa.
C. sự phân hủy, sự khử.
D. sự oxi hóa, sự phân hủy.
Câu 13: Nồng độ mol của dung dịch cho biết
A. số gam dung môi có trong 100 gam dung dịch.
B. số gam chất tan có trong 100 gam dung dịch.
C. số mol chất tan có trong một lít dung dịch.
D. số mol chất tan có trong dung dịch.
Câu 14: Cho một thìa nhỏ đường vào cốc nước, khuấy nhẹ. Đường tan trong nước tạo thành dung dịch đường. Chất tan là
A. nước đường. B. nước.
C. nước và đường. D. đường.
Câu 15: Đốt cháy 12,4 gam P trong bình chứa 20 gam khí oxi. Khối lượng P2O5 thu được sau phản ứng là
A. 14,2 gam. B. 32,4 gam. C. 35,5 gam. D. 28,4 gam.
Câu 16: Ứng dụng nào sau đây không phải của khí hiđro?
A. Dùng làm nhiên liệu cho động cơ tên lửa.
B. Dùng để bơm vào khinh khí cầu, bóng thám không.
C. Dùng trong đèn xì oxi-hiđro để hàn cắt kim loại.
D. Dùng để dập tắt đám cháy.
Câu 17: Kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường?
A. Mg. B. Cu. C. Fe. D. Na.
Câu 18: Trong số những dung dịch dưới đây, dung dịch nào làm cho quỳ tím không đổi màu?
A. HNO3. B. NaOH. C. NaCl. D. Ca(OH)2.
Câu 19: Khối lượng nước cần thiết để pha chế 240 gam dung dịch CaCl2 20% là
A. 192 gam. B. 180 gam. C. 198 gam. D. 200 gam.
Câu 20: Hòa tan 75 gam đường vào nước, thu được dung dịch đường có nồng độ 25%. Khối lượng nước cần dùng cho sự pha chế là:
A. 150 gam. B. 200 gam. C. 225 gam. D. 250 gam.
Câu 21: Dãy chỉ gồm các oxit axit là
A. CO, CO2, SO2, Al2O3.
B. CO2, SO2, SO3, P2O5.
C. FeO, SiO2, CaO, Fe2O3.
D. Na2O, BaO, H2O, ZnO.
Câu 22: Trong công nghiệp, điều chế H2 bằng cách
A. cho axit HCl tác dụng với kim loại kẽm.
B. điện phân nước.
C. khử oxit kim loại.
D. nhiệt phân hợp chất giàu hiđro.
Câu 23: Thực hiện các thí nghiệm sau:
(1) Sục khí CO2 vào dung dịch Ca(OH)2.
(2) Cho khí H2 qua sắt (III) oxit nung nóng.
(3) Đốt cháy Fe trong bình đựng khí Cl2.
(4) Sục khí SO2 vào dung dịch KOH.
Số thí nghiệm có xảy ra phản ứng oxi hóa – khử là
A. 1. B. 2. C. 3. D. 4.
Câu 24: Để chuyển đổi từ một dung dịch NaCl bão hòa thành một dung dịch chưa bão hòa (ở nhiệt độ phòng). Ta có thể
A. thêm NaCl và khuấy nhẹ.
B. thêm lượng dư nước và khuấy nhẹ đến khi muối ăn đã tan hết.
C. ngâm trong nước lạnh.
D. khuấy liên tục khoảng 5 phút.
Câu 25: Trong phòng thí nghiệm, cần điều chế 4,48 lít khí O2 (đktc) thì dùng chất nào sau đây làm để có lợi nhất?
A. KClO3. B. KMnO4. C. KNO3. D. Không khí.
Câu 26: Để tạo ra được 3,6 gam nước thì thể tích khí hiđro và khí oxi (ở đktc) cần tác dụng với nhau lần lượt là
A. 4,48 lít và 4,48 lít. B. 4,48 lít và 2,24 lít.
C. 2,24 lít và 4,48 lít. D. 2,24 lít và 2,24 lít.
Câu 27: Có 3 oxit sau: MgO, P2O5, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử nào sau đây?
A. Chỉ dùng nước.
B. Chỉ dùng dung dịch kiềm.
C. Chỉ dùng axit.
D. Dùng nước và giấy quỳ.
Câu 28:Sự oxi hóa có tỏa nhiệt nhưng không phát sáng được gọi là
A. sự cháy. B. sự oxi hóa chậm.
C. sự tự bốc cháy. D. sự tỏa nhiệt.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. D |
2. D |
3. D |
4. A |
5. C |
6. A |
7. C |
8. C |
9. C |
10. C |
11. A |
12. A |
13. C |
14. C |
15. A |
16. D |
17. D |
18. C |
19. A |
20. C |
21. B |
22. B |
23. B |
24. B |
25. A |
26. B |
27. D |
28. B |
Câu 1:
Đáp án D
Oxit là hợp chất chứa hai nguyên tố, trong đó một nguyên tố là oxi.
⇒ CuS không phải oxit.
Câu 2:
Đáp án D
D sai vì oxi ít tan trong nước.
Câu 3:
Đáp án D
100 gam nước ở 25oC hòa tan tối đa được 36,2 gam NaCl.
⇒ 250 gam nước ở 25oC hòa tan tối đa được:
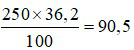 gam NaCl.
gam NaCl.
Câu 4:
Đáp án A
Một số bazơ tan hay gặp: NaOH, KOH, Ca(OH)2, Ba(OH)2.
Câu 5:
Đáp án C
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
⇒ Phản ứng C không là phản ứng thế.
Câu 6:
Đáp án A
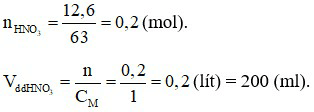
Câu 7:
Đáp án C
- Ở giai đoạn đầu, ta được dung dịch đường, dung dịch này vẫn có thể hòa tan thêm đường. Ta có dung dịch đường chưa bão hòa.
- Ở giai đoạn sau, ta được một dung dịch đường không thể hòa tan thêm đường. Ta có dung dịch đường bão hòa.
Câu 8:
Đáp án C
Thí nghiệm 1: Không có phản ứng hóa học xảy ra.
Thí nghiệm 2: Bột CuO màu đen chuyển dần thành màu đỏ gạch và có những giọt nước tạo thành.
Phương trình hóa học: H2 + CuO H2O + Cu.
H2O + Cu.
Câu 9:
Đáp án C
Phân tử axit gồm có một hay nhiều nguyên tử hiđro liên kết với gốc axit, các nguyên tử hiđro này có thể thay thế bằng các nguyên tử kim loại.
⇒ Dãy gồm các axit: HCl, H2SO4, HNO3.
Câu 10:
Đáp án C
Chất có khả năng hòa tan chất khác để tạo thành dung dịch được gọi là dung môi.
Câu 11:
Đáp án A
Thành phần thể tích của không khí gồm 21% khí oxi, 78% khí nitơ, 1% các khí khác (CO2, CO, khí hiếm, …)
Câu 12:
Đáp án A
Sự tách oxi khỏi hợp chất gọi là sự khử. Sự tác dụng của oxi với một chất là sự oxi hóa. Vậy:
Quá trình Al tạo thành Al2O3 là sự oxi hóa.
Quá trình Fe2O3 tạo thành Fe là sự khử.
Câu 13:
Đáp án C
Nồng độ mol (kí hiệu là CM) của dung dịch cho biết số mol chất tan có trong 1 lít dung dịch.
Câu 14:
Đáp án C
Đường là chất tan, nước là dung môi, nước đường là dung dịch.
Câu 15:
Đáp án A
Ta có: 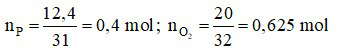
Phương trình hóa học:
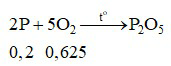
Nhận thấy: 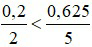 ⇒ P hết, O2 dư.
⇒ P hết, O2 dư.
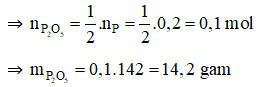
Câu 16:
Đáp án D
Khí hiđro cháy mạnh trong khí oxi, do đó không dùng để dập tắt đám cháy.
Phương trình hóa học: 2H2 + O2 2H2O.
2H2O.
Câu 17:
Đáp án D
Nước tác dụng với một số kim loại ở nhiệt độ thường (như Na, K, Ca, Ba ...) tạo thành bazơ tan và khí hiđro.
Phương trình hoá học: 2Na + 2H2O → 2NaOH + H2↑.
Câu 18:
Đáp án C
Dung dịch HNO3 làm quỳ tím chuyển sang màu đỏ.
Dung dịch NaOH, Ca(OH)2 làm quỳ tím chuyển sang màu xanh.
Dung dịch NaCl không làm quỳ tím đổi màu.
Câu 19:
Đáp án A
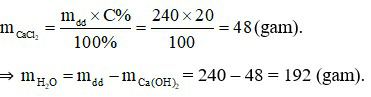
Câu 20:
Đáp án C
Khối lượng dung dịch đường pha chế được là:
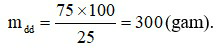
Khối lượng nước cần dùng cho sự pha chế là:
mdm = 300 – 75 = 225 (gam).
Câu 21:
Đáp án B
Oxit axit thường là oxit của phi kim, tương ứng với một axit.
⇒ Dãy chỉ gồm các oxit axit: CO2, SO2, SO3, P2O5.
Câu 22:
Đáp án B
Trong công nghiệp, điều chế H2 bằng cách điện phân nước hoặc dùng than khử oxi của H2O trong lò khí than hoặc điều chế H2 từ khí tự nhiên, khí dầu mỏ.
2H2O 2H2↑ + O2↑
2H2↑ + O2↑
Câu 23:
Đáp án B
(1) CO2 + Ca(OH)2 → CaCO3↓ + H2O.
(2) Fe2O3 + 3H2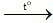 2Fe + 3H2O.
2Fe + 3H2O.
(3) 2Fe + 3Cl2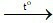 2FeCl3.
2FeCl3.
(4) SO2 + KOH →KHSO3 hoặc SO2 + 2KOH →K2SO3 + H2O.
⇒ Số thí nghiệm có xảy ra phản ứng oxi hóa – khử là: (2), (3).
Câu 24:
Đáp án B
Ở một nhiệt độ xác định:
Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan.
⇒ Để chuyển đổi từ một dung dịch NaCl bão hòa thành một dung dịch chưa bão hòa (ở nhiệt độ phòng), ta có thể thêm lượng dư nước và khuấy nhẹ đến khi muối ăn đã tan hết.
Câu 25:
Đáp án A
Trong phòng thí nghiệm để điều chế oxi, người ta nung những hợp chất giàu oxi và dễ bị phân hủy như KClO3, KMnO4, KNO3.
Ta có: 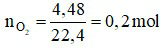
Phương trình hóa học:
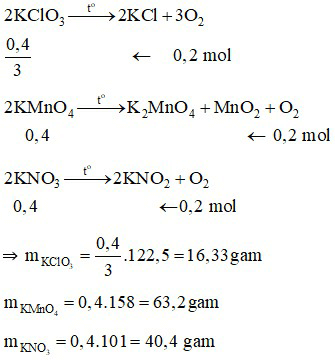
⇒ Dùng KClO3 là lợi nhất.
Câu 26:
Đáp án B
Phương trình hoá học: 2H2 + O2 2H2O.
2H2O.
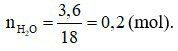
Theo phương trình hoá học: 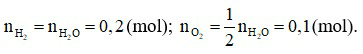
Câu 27:
Đáp án D
Lấy các mẫu thử cho vào 3 ống nghiệm có đánh số thứ tự.
- Cho ít nước vào các ống nghiệm và lắc đều thấy P2O5, Na2O tan ra tạo dung dịch đồng nhất, còn MgO không tan.
P2O5 + 3H2O → 2H3PO4.
Na2O + H2O ⟶ 2NaOH.
- Cho hai mẩu quỳ vào 2 ống nghiệm chứa dung dịch, ta thấy:
+ Quỳ đổi sang màu đỏ ⇒ Chất đầu là P2O5.
+ Quỳ đổi sanh màu xanh ⇒ Chất đầu là Na2O.
Câu 28:
Đáp án B
Sự oxi hóa có tỏa nhiệt nhưng không phát sáng được gọi là sự oxi hóa chậm.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 3)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Phương pháp điều chế khí oxi trong phòng thí nghiệm là
A. Đun nóng KMnO4 hoặc KClO3 ở nhiệt độ cao.
B. Đi từ không khí.
C. Điện phân nước.
D. Nhiệt phân CaCO3.
Câu 2: Có 3 oxit sau: MgO, P2O5, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử nào sau đây?
A. Chỉ dùng nước.
B. Chỉ dùng dung dịch kiềm.
C. Chỉ dùng axit.
D. Dùng nước và giấy quỳ.
Câu 3: Dung dịch là
A. hỗn hợp gồm dung môi và chất tan.
B. hợp chất gồm dung môi và chất tan.
C. hỗn hợp đồng nhất gồm nước và chất tan.
D. hỗn hợp đồng nhất gồm dung môi và chất tan.
Câu 4: Trong không khí, khí nitơ chiếm tỉ lệ về thể tích là bao nhiêu?
A. 1% B. 21% C. 49% D. 78%.
Câu 5: Nước hoá hợp với các oxit: CO2, SO3, P2O5, N2O5 tạo ra axit tương ứng là
A. H2CO3, H2SO3, H3PO4, HNO2.
B. H2CO3, H2SO3, H3PO3, HNO2.
C. H2CO3, H2SO4, H3PO3, HNO3.
D. H2CO3, H2SO4, H3PO4, HNO3.
Câu 6: Ý nghĩa 98% trong bình đựng dung dịch H2SO4 là
A. 98 gam H2SO4 có trong 100 gam dung dịch.
B. 98 gam H2SO4 có trong 100 gam nước.
C. 98 gam H2SO4 có trong 1 lít dung dịch.
D. 98 gam H2SO4 có trong 100 ml dung môi.
Câu 7: Khi tăng nhiệt độ thì độ tan của chất rắn trong nước thay đổi như thế nào?
A. Phần lớn là tăng. B. Đều giảm.
C. Phần lớn là giảm. D. Đều tăng.
Câu 8: Tên gọi của H2SO3 là
A. Hiđrosunfua. B. Axit sunfuric.
C. Axit sunfuhiđric. D. Axit sunfurơ.
Câu 9: Cho phương trình hóa học: 2Al + Fe2O3 Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
A. sự oxi hóa, sự khử.
B. sự khử, sự oxi hóa.
C. sự phân hủy, sự khử.
D. sự oxi hóa, sự phân hủy.
Câu 10: Hòa tan 50 gam NaCl vào 450 gam nước thì thu được dung dịch có nồng độ là
A. 15%. B. 20%. C. 10%. D. 5%.
Câu 11: Ở 20oC, khi hòa tan 40 gam kali nitrat vào 95 gam nước thì được dung dịch bão hòa. Vậy ở 20oC, độ tan của kali nitrat là:
A. 40,1 gam. B. 44,2 gam. C. 42,1 gam. D. 43,5 gam.
Câu 12: Khi phân hủy có xúc tác 15,8 gam KMnO4, thể tích khí oxi thu được ở đktc là
A. 3,36 lít. B. 11,2 lít. C. 1,12 lít. D. 33,6 lít.
Câu 13: Đốt cháy hoàn toàn 56 lít khí hiđro (ở đktc) với khí oxi dư. Khối lượng nước thu được là
A. 45 gam. B. 36 gam. C. 24 gam. D. 18 gam.
Câu 14: Công thức Fe2O3 có tên gọi là gì?
A. Sắt oxit. B. Sắt (II) oxit.
C. Sắt (III) oxit. D. Sắt từ oxit.
Câu 15: Em hãy chọn phương pháp dùng để dập tắt ngọn lửa do xăng, dầu trong các phương án sau:
A. Dùng quạt để quạt tắt ngọn lửa
B. Dùng vải dày hoặc cát phủ lên ngọn lửa.
C. Dùng nước tưới lên ngọn lửa.
D. Không có phương án dập tắt phù hợp.
Câu 16: Phần trăm về khối lượng của nguyên tố H trong nước là
A. 88,9%. B. 11,1%. C. 16,2%. D. 83,8%.
Câu 17: Hợp chất Na2SO4 có tên gọi là
A. natri sunfat. B. natri sunfit.
C. sunfat natri. D. natri sunfuric.
Câu 18: Trong 200 ml dung dịch có hòa tan 8,5 gam NaNO3. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
Câu 19: Làm sao để quá trình hòa tan chất rắn vào nước diễn ra nhanh hơn?
A. khuấy dung dịch.
B. đun nóng dung dịch.
C. nghiền nhỏ chất rắn.
D. cả ba cách đều được.
Câu 20: Phát biểu nào sau đây về oxi là không đúng?
A. Oxi là phi kim hoạt động hoá học rất mạnh, nhất là ở nhiệt độ cao.
B. Oxi tạo oxit axit với hầu hết kim loại.
C. Oxi không có mùi và không vị.
D. Oxi cần thiết cho sự sống.
Câu 21: Phát biểu nào sau đây không đúng?
A. Thu khí H2 vào ống nghiệm bằng cách đẩy không khí hay đẩy nước.
B. Nhận ra khí H2 bằng que đóm đang cháy.
C. Khí hiđro khử đồng (II) oxit ở nhiệt độ cao thành kim loại Cu.
D. Khí hiđro có tính oxi hóa.
Câu 22: Cho các phản ứng hóa học sau:
(1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
(2) K2O + H2O → 2KOH
(3) Zn + H2SO4 → ZnSO4 + H2↑
(4) CuO + 2HCl → CuCl2 + H2O
(5) Mg + CuCl2 → MgCl2 + Cu
(6) HCl + NaOH → NaCl + H2O
Số phản ứng thuộc loại phản ứng thế là
A. 2. B. 3. C. 4. D. 5.
Câu 23: Khối lượng CaCl2 cần thiết để pha chế 200 gam dung dịch CaCl2 20% là
A. 80 gam. B. 20 gam. C. 40 gam. D. 100 gam.
Câu 24: Dãy oxit nào có tất cả các oxit đều tác dụng được với nước?
A. SO3, CaO, CuO, Fe2O3.
B. SO3, Na2O, CaO, P2O5.
C. ZnO, CO2, SiO2, PbO.
D. SO2, Al2O3, HgO, K2O.
Câu 25: Phát biểu không đúng là:
A. Hiđro là chất khí nhẹ nhất trong các chất khí.
B. Khí hiđro có tính khử, có thể kết hợp với nguyên tố oxi trong một số oxit kim loại.
C. Hiđro có nhiều ứng dụng, chủ yếu do tính chất rất nhẹ, do tính khử và khi cháy tỏa nhiều nhiệt.
D. Hiđro có thể tác dụng với tất cả oxit kim loại ở nhiệt độ cao.
Câu 26: Dung dịch axit HCl làm quỳ tím chuyển sang màu
A. xanh. B. đen. C. tím. D. đỏ.
Câu 27: Trong các phản ứng hóa học sau, phản ứng nào là phản ứng hóa hợp?
A. 4Al + 3O2 2Al2O3.
2Al2O3.
B. CaCO3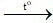 CaO + CO2.
CaO + CO2.
C. Fe + H2O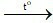 FeO + H2↑.
FeO + H2↑.
D. CO + CuO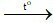 Cu + CO2.
Cu + CO2.
Câu 28: Dầu ăn có thể hòa tan trong
A. nước. B. nước muối.
C. xăng. D. nước đường.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. A |
2. D |
3. D |
4. D |
5. D |
6. A |
7. A |
8. D |
9. A |
10. C |
11. C |
12. C |
13. A |
14. C |
15. B |
16. B |
17. A |
18. D |
19. D |
20. B |
21. D |
22. B |
23. C |
24. B |
25. D |
26. D |
27. A |
28. C |
Câu 1:
Đáp án A
Trong phòng thí nghiệm, người ta nhiệt phân những hợp chất giàu oxi và dễ bị phân hủy bởi nhiệt như KMnO4 hoặc KClO3.
Câu 2:
Đáp án D
Lấy các mẫu thử cho vào 3 ống nghiệm có đánh số thứ tự.
- Cho ít nước vào các ống nghiệm và lắc đều thấy P2O5, Na2O tan ra tạo dung dịch đồng nhất, còn MgO không tan.
P2O5 + 3H2O → 2H3PO4
Na2O + H2O ⟶ 2NaOH
- Cho hai mẩu quỳ vào 2 ống nghiệm chứa dung dịch, ta thấy:
+ Quỳ đổi sang màu đỏ ⇒ Chất đầu là P2O5.
+ Quỳ đổi sanh màu xanh ⇒ Chất đầu là Na2O.
Câu 3:
Đáp án D
Dung dịch là hỗn hợp đồng nhất gồm dung môi và chất tan.
Câu 4:
Đáp án D
Trong không khí, khí nitơ chiếm tỉ lệ về thể tích là 78%.
Câu 5:
Đáp án D
CO2 + H2O ⇄ H2CO3
SO3 + H2O ⟶ H2SO4
P2O5 + 3H2O ⟶ 2H3PO4
N2O5 + H2O ⟶ 2HNO3
Câu 6:
Đáp án A
Ý nghĩa 98% trong bình đựng dung dịch H2SO4 là sẽ có 98 gam H2SO4 có trong 100 gam dung dịch.
Câu 7:
Đáp án A
Khi tăng nhiệt độ thì độ tan của chất rắn trong nước phần lớn là tăng.
Vì có phần nhỏ chất rắn khi tăng nhiệt độ thì độ tăng giảm.
Câu 8:
Đáp án D
Axit H2SO3 là axit có ít nguyên tử oxi.
Tên gọi axit: axit + tên phi kim + ơ.
⇒ Tên gọi của H2SO3 là axit sunfurơ.
Câu 9:
Đáp án A
Sự tách oxi khỏi hợp chất gọi là sự khử. Sự tác dụng của oxi với một chất là sự oxi hóa. Vậy:
Quá trình Al tạo thành Al2O3 là sự oxi hóa.
Quá trình Fe2O3 tạo thành Fe là sự khử.
Câu 10:
Đáp án C
Khối lượng dung dịch là:
mdd = 50 + 450 = 500 gam
Nồng độ của NaCl trong dung dịch là:
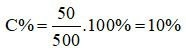
Câu 11:
Đáp án C
Độ tan của 1 chất là số gam chất đó hòa tan được trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định
⇒ Độ tan của kali nitrat trong 100 gam nước là: 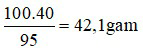
Câu 12:
Đáp án C
Ta có: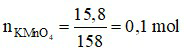
Phương trình hóa học:
2KMnO4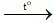 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
Theo phương trình ta có: 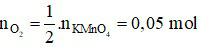
⇒ 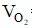 = 0,05.22,4 = 1,12 lít
= 0,05.22,4 = 1,12 lít
Câu 13:
Đáp án A
Phương trình hoá học: 2H2 + O2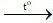 2H2O.
2H2O.
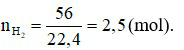
Theo phương trình hoá học: 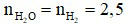 (mol).
(mol).
⇒ 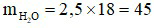 (gam).
(gam).
Câu 14:
Đáp án C
Công thức Fe2O3 có tên gọi là sắt (III) oxit.
Câu 15:
Đáp án B
Để dập tắt ngọn lửa do xăng, dầu cháy dùng vải dày hoặc cát phủ lên ngọn lửa.
Lưu ý: Không dùng nước để dập tắt đám cháy do xăng, dầu vì xăng dầu nhẹ hơn nước nên sẽ nổi lên trên mặt nước và làm cho đám cháy lan rộng hơn.
Câu 16:
Đáp án B
Công thức hoá học của nước là H2O.
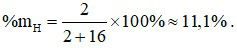
Câu 17:
Đáp án A
Tên muối: tên kim loại (kèm hóa trị nếu kim loại có nhiều hóa trị) + tên gốc axit.
⇒ Na2SO4: natri sunfat.
Câu 18:
Đáp án D
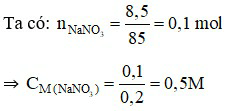
Câu 19:
Đáp án D
Để quá trình hòa tan chất rắn vào nước diễn ra nhanh hơn thì ta cần:
- Khuấy dung dịch
- Đun nóng dung dịch
- Nghiền nhỏ chất rắn
Câu 20:
Đáp án B
B sai vì oxi tạo oxit bazơ với hầu hết kim loại.
Câu 21:
Đáp án D
D sai vì khí hiđro H2 có tính khử.
Câu 22:
Đáp án B
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
⇒ Phản ứng thế: (1), (3), (5).
Câu 23:
Đáp án C
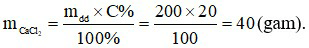
Câu 24:
Đáp án B
Dãy gồm các chất đều tác dụng với nước: SO3, Na2O, CaO, P2O5.
SO3 + H2O ⟶ H2SO4
Na2O + H2O ⟶ 2NaOH
CaO + H2O ⟶ Ca(OH)2
P2O5 + 3H2O ⟶ 2H3PO4
Câu 25:
Đáp án D
Khí hiđro có tính khử, có thể tác dụng với một số oxit kim loại ở nhiệt độ cao (như CuO, Fe2O3 …).
Câu 26:
Đáp án D
Dung dịch axit HCl làm quỳ tím chuyển sang màu đỏ.
Câu 27:
Đáp án A
Phản ứng hóa học là phản ứng mà hai hay nhiều chất phản ứng với nhau sinh ra một chất duy nhất.
Câu 28:
Đáp án C
Dầu ăn có thể hòa tan trong xăng.
⇒ Xăng là dung môi của dầu ăn, nước không là dung môi của dầu ăn.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 4)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
Câu 1: Dãy oxit nào có tất cả các oxit đều tác dụng được với nước?
A. SO3, CaO, CuO, Fe2O3.
B. SO3, Na2O, CaO, P2O5.
C. ZnO, CO2, SiO2, PbO.
D. SO2, Al2O3, HgO, K2O.
Câu 2: Ở điều kiện thường, hiđro là chất ở trạng thái nào?
A. Rắn. B. Lỏng.
C. hợp chất rắn. D. Khí.
Câu 3:Hợp chất nào sau đây không phải là muối?
A. Đồng (II) nitrat. B. Kali clorua.
C. Sắt (II) sunfat. D. Canxi hiđroxit.
Câu 4: Chất tan là
A. hỗn hợp đồng nhất của dung môi và chất tan.
B. chất bị hòa tan trong dung môi.
C. chất có khả năng tác dụng với nước.
D. chất có khả năng hòa tan chất khác để tạo thành dung dịch.
Câu 5: Phản ứng nào sau đây không phải là phản ứng oxi hóa – khử?
A. C + O2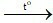 CO2.
CO2.
B. Fe2O3 + 3CO 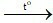 2Fe + 3CO2.
2Fe + 3CO2.
C. CaCO3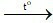 CaO + CO2.
CaO + CO2.
D. 3Fe + 2O2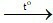 Fe3O4.
Fe3O4.
Câu 6: Điều kiện phát sinh phản ứng cháy là
A. Chất phải nóng đến nhiệt độ cháy
B. Phải đủ khí oxi cho sự cháy.
C. Cần phải có chất xúc tác cho phản ứng cháy
D. Cả A và B
Câu 7: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành đỏ?
A. HCl, H2SO4, HNO3, NaCl.
B. HCl, H2SO4, Ba(NO3)2, NaOH.
C. Ba(OH)2, Na2SO4, H3PO4, HNO3.
D. HCl, H2SO4, H3PO4, HNO3.
Câu 8: Cho dung dịch NaOH 4M có D = 1,43 g/ml. Tính C% của dung dịch NaOH đã cho?
A. 11,88%. B. 12,20%. C. 11,19%. D. 11,79%.
Câu 9: Ở một nhiệt độ xác định, dung dịch bão hòa là dung dịch
A. không thể hòa tan thêm chất tan.
B. có thể hòa tan thêm chất tan.
C. có thể hòa tan nhiều chất tan cùng một lúc.
D. không thể hòa tan nhiều chất tan cùng một lúc.
Câu 10: Có thể điều chế được bao nhiêu gam O2 từ 31,6 gam KMnO4?
A. 1,6 gam. B. 16 gam. C. 3,2 gam. D. 6,4 gam.
Câu 11: Tên gọi của P2O5 là
A. Điphotpho trioxit. B. Photpho oxit.
C. Điphotpho pentaoxit. D. Điphotpho oxit.
Câu 12: Sau phản ứng của CuO và H2 thì có hiện tượng gì
A. Sau phản ứng, chất rắn màu đen chuyển thành xanh lam
B. Sau phản ứng, chất rắn màu đen chuyển thành đỏ
C. Có chất khí bay lên
D. Không có hiện tượng
Câu 13: Phản ứng nào sau đây là phản ứng phân hủy?
A. 4P + 5O2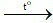 2P2O5
2P2O5
C. 2Fe(OH)3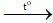 Fe2O3 + 3H2O
Fe2O3 + 3H2O
C. 2CO + O2 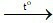 2CO2
2CO2
D. 2Cu + O2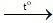 2CuO
2CuO
Câu 14: Hoà tan 4 gam NaOH vào nước, thu được 200 ml dung dịch. Nồng độ mol của dung dịch NaOH là
A. 0,5M. B. 0,1M. C. 0,2M. D. 0,25M.
Câu 15: Trộn 2 ml rượu etylic (cồn) với 20 ml nước cất. Phát biểu nào sau đây là đúng?
A. Nước là chất tan, rượu etylic là dung môi.
B. Rượu etylic là chất tan, nước là dung môi.
C. Nước hoặc rượu etylic có thể là chất tan hoặc dung môi.
D. Cả hai chất nước và rượu etylic vừa là chất tan, vừa là dung môi.
Câu 16: Nhận xét nào sau đây đúng về oxi?
A. Oxi là chất khí tan vô hạn trong nước và nặng hơn không khí.
B. Oxi là chất khí ít tan trong nước và nặng hơn không khí.
C. Oxi là chất khí không duy trì sự cháy, hô hấp.
D. Oxi là chất khí không tan trong nước và nặng hơn không khí.
Câu 17: Hiện tượng khi cho viên kẽm (Zn) vào dung dịch axit clohiđric (HCl) là
A. có kết tủa trắng.
B. có thoát khí màu nâu đỏ.
C. dung dịch có màu xanh lam.
D. viên kẽm tan dần, có khí không màu thoát ra.
Câu 18: Khối lượng nước cần dùng để pha chế 150 gam dung dịch NaCl 5% từ dung dịch NaCl 10% là
A. 56,8 gam. B. 67,5 gam. C. 60,8 gam. D. 59,4 gam.
Câu 19: Ở nhiệt độ 18oC, khi hòa tan hết 74,2 gam Na2CO3 trong 350 gam nước thì được dung dịch bão hòa. Độ tan của muối Na2CO3 ở nhiệt độ này là
A. 18,4. B. 21,2. C. 42,1. D. 74,2.
Câu 20:Trong thí nghiệm điều chế khí oxi, tại sao người ta thu khí oxi bằng phương pháp đẩy nước?
A. Khí oxi nhẹ hơn nước.
B. Khí oxi tan rất nhiều trong nước.
C. Khí O2 tan ít trong nước.
D. Khí oxi hóa lỏng ở - 183oC.
Câu 21: Đốt hoàn toàn 2 mol khí H2 thì thể tích O2 cần dùng (đktc) là bao nhiêu?
A. 22,4 lít. B. 11,2 lít. C. 44,8 lít. D. 8,96 lít
Câu 22: Trường hợp nào sau đây không có sự phù hợp giữa tên gọi và công thức hóa học?
A. HNO3: axit nitric.
B. CuSO4: đồng (II) sunfat.
C. Fe2O3: sắt (III) oxit.
D. FeS: sắt sunfua.
Câu 23: Phản ứng thế là phản ứng hóa học
A. giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
B. xảy ra đồng thời sự oxi hóa và sự khử.
C. trong đó một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
D. trong đó một chất sinh ra hai hay nhiều chất mới.
Câu 24: Công thức tính nồng độ phần trăm là
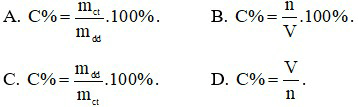
Câu 25: Độ tan của chất khí sẽ tăng nếu
A. tăng nhiệt độ và tăng áp suất.
B. tăng nhiệt độ và giảm áp suất.
C. giảm nhiệt độ và tăng áp suất.
D. giảm nhiệt độ và giảm áp suất.
Câu 26: Chỉ ra các oxit bazơ trong dãy oxit sau: P2O5, CuO, BaO, Na2O, SO3.
A. CaO, CuO, Na2O. B. P2O5, CaO, CuO.
C. CaO, Na2O, SO3. D. P2O5, CaO, SO3.
Câu 27: Sự giống nhau giữa sự cháy và sự oxi hóa chậm là
A. Phát sáng. B. Tỏa nhiệt.
C. Sự oxi hóa xảy ra chậm. D. Cháy.
Câu 28: Dãy gồm các kim loại tác dụng với nước ở nhiệt độ thường là
A. Fe, Mg, Al. B. Fe, Cu, Ag.
C. Zn, Al, Ag. D. Na, K, Ca.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
1. B |
2. D |
3. D |
4. B |
5. C |
6. D |
7. D |
8. C |
9. A |
10. C |
11. C |
12. B |
13. C |
14. A |
15. B |
16. B |
17. D |
18. B |
19. B |
20. C |
21. A |
22. D |
23. A |
24. A |
25. C |
26. A |
27. D |
28. D |
Câu 1:
Đáp án B
Dãy gồm các chất đều tác dụng với nước: SO3, Na2O, CaO, P2O5.
SO3 + H2O ⟶ H2SO4
Na2O + H2O ⟶ 2NaOH
CaO + H2O ⟶ Ca(OH)2
P2O5 + 3H2O ⟶ 2H3PO4
Câu 2:
Đáp án D
Ở điều kiện thường, hiđro là chất ở trạng thái khí.
Câu 3:
Đáp án D
Canxi hiđroxit (Ca(OH)2) không phải muối mà thuộc loại hợp chất bazơ.
Câu 4:
Đáp án B
Chất tan là chất bị hòa tan trong dung môi.
Câu 5:
Đáp án C
Phản ứng oxi hóa – khử là phản ứng xảy ra đồng thời quá trình khử và quá trình oxi hóa.
⇒ Phản ứng C là phản ứng phân hủy.
Câu 6:
Đáp án D
Điều kiện phát sinh phản ứng cháy là:
- Chất phải nóng đến nhiệt độ cháy.
- Phải có đủ khí oxi cho sự cháy.
Câu 7:
Đáp án D
Dung dịch axit làm quỳ tím chuyển sang màu đỏ.
⇒ Dãy gồm các axit: HCl, H2SO4, H3PO4, HNO3.
Câu 8:
Đáp án C
Đổi D = 1,43 g/ml = 1430 g/lít.
Gọi thể tích của dung dịch là V lít
⇒ mdd NaOH = 1430.V (gam)
Số mol của NaOH là:
nNaOH = 4V (mol)
⇒ 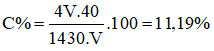
Câu 9:
Đáp án A
Ở một nhiệt độ xác định:
Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan.
Câu 10:
Đáp án C
Ta có: 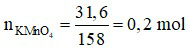
Phương trình hóa học:
2KMnO4 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
Theo phương trình, ta có: 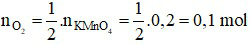
⇒ 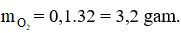
Câu 11:
Đáp án C
P là phi kim có nhiều hóa trị.
Tên gọi: Tên phi kim (có tiền tố chỉ số nguyên tử phi kim) + oxit (có tiền tố chỉ số nguyên tử oxi)
⇒ P2O5: điphotpho pentaoxit.
Câu 12:
Đáp án B
Phản ứng: CuO + H2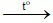 Cu + H2O
Cu + H2O
Chất rắn ban đầu là CuO có màu đen, sau phản ứng chuyển thành Cu có màu đỏ
Câu 13:
Đáp án C
Phản ứng phân hủy là phản ứng một chất bị phân hủy thành hai hay nhiều chất khác.
⇒ Phương trình C thuộc loại phản ứng phân hủy.
Câu 14:
Đáp án A
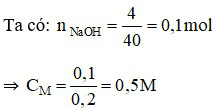
Câu 15:
Đáp án B
Rượu etylic tan vô hạn trong nước hoặc có thể nói nước tan vô hạn trong rượu etylic. Theo đề bài cho V rượu etylic (2 ml) ít hơn V nước (20 ml) nên câu diễn đạt đúng: “Rượu etylic là chất tan, nước là dung môi”.
Câu 16:
Đáp án B
A. sai vì oxi là chất khí ít tan trong nước.
B. đúng.
C. sai vì khí oxi duy trì sự cháy và sự hô hấp.
D. sai vì khí oxi ít tan trong nước.
Câu 17:
Đáp án D
Hiện tượng khi cho viên kẽm (Zn) vào dung dịch axit clohiđric (HCl) là viên kẽm tan dần, có khí không màu thoát ra.
Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2↑
Câu 18:
Đáp án B
150 gam dung dịch NaCl 5%:
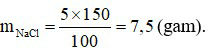
Khối lượng dung dịch NaCl 10% là:
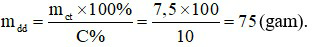
⇒ Khối lượng nước cần dùng:
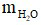 = 75 – 7,5 = 67,5 (gam).
= 75 – 7,5 = 67,5 (gam).
Câu 19:
Đáp án B
350 gam nước ở 18oC hòa tan tối đa được 74,2 gam Na2CO3.
⇒ 100 gam nước ở 18oC hòa tan tối đa được:
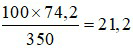 gam Na2CO3.
gam Na2CO3.
⇒ Độ tan của Na2CO3 ở 18oC là 21,2 gam
Câu 20:
Đáp án C
Trong thí nghiệm điều chế khí oxi, người ta thu khí oxi bằng phương pháp đẩy nước vì khí oxi ít tan trong nước.
Câu 21:
Đáp án A
Phương trình hóa học:
2H2 + O2 → 2H2O
Theo phương trình, ta có: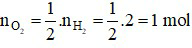
⇒ Thể tích khí O2 cần dùng là: 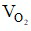 = 1.22,4 = 22,4 lít
= 1.22,4 = 22,4 lít
Câu 22:
Đáp án D
FeS: sắt (II) sunfua
Câu 23:
Đáp án A
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Ví dụ: Fe + 2HCl → FeCl2 + H2 ↑
Nguyên tử của đơn chất Fe đã thay thế nguyên tử của nguyên tố hiđro trong hợp chất (axit).
Câu 24:
Đáp án A
Công thức tính nồng độ phần trăm là 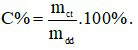
Câu 25:
Đáp án C
Độ tan của chất khí sẽ tăng nếu giảm nhiệt độ và tăng áp suất.
Câu 26:
Đáp án A
Các oxit bazơ gồm: CuO, BaO, Na2O.
Câu 27:
Đáp án D
Sự giống nhau giữa sự cháy và sự oxi hóa chậm là đều tỏa nhiệt
Câu 28:
Đáp án D
Dãy gồm các kim loại tác dụng với nước ở nhiệt độ thường là: Na, K, Ca.
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 5)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
I. Trắc nghiệm (6 điểm)
Câu 1: Đốt cháy 3,1 gam photpho trong bình chứa 11,2 lít khí oxi (đktc). Sau phản ứng trong bình có những chất nào?
A. Photpho và khí oxi.
B. Photpho, khí oxi và điphotpho pentaoxit.
C. Photpho và điphotpho pentaoxit.
D. Khí oxi và điphotpho pentaoxit.
Câu 2: Oxit nào sau đây tác dụng với nước tạo thành bazơ?
A. CaO. B. SO3. C. Al2O3. D. CuO.
Câu 3: Hoà tan 124 gam Na2O vào 876 ml nước, phản ứng tạo ra NaOH. Nồng độ phần trăm của dung dịch thu được là
A. 16%. B. 17%. C. 18%. D. 19%.
Câu 4: Trộn 2 ml rượu etylic (cồn) với 20 ml nước cất. Phát biểu nào sau đây là đúng?
A. Nước là chất tan, rượu etylic là dung môi.
B. Rượu etylic là chất tan, nước là dung môi.
C. Nước hoặc rượu etylic có thể là chất tan hoặc dung môi.
D. Cả hai chất nước và rượu etylic vừa là chất tan, vừa là dung môi.
Câu 5: Cho mẩu Na vào cốc nước dư thấy có 4,48 lít khí bay lên ở đktc. Tính khối lượng Na phản ứng
A. 9,2 gam. B. 4,6 gam. C. 2 gam. D. 9,6 gam.
Câu 6: Cho các chất sau: H2SO3, KOH, FeCl3, Na2CO3, Ca(OH)2, HNO3, CuSO4. Số axit, bazơ và muối lần lượt là
A. 3, 2, 2. B. 2, 3, 2. C. 2, 2, 3. D. 1, 3, 3.
Câu 7: Đâu là phản ứng thế trong các phản ứng sau?
A. Fe + 2HCl → FeCl2 + H2↑
B. NaOH + HCl → NaCl + H2O
C. 2Cu + O2 2CuO
2CuO
D. CuO + 2HCl → CuCl2 + H2O
Câu 8: Nồng độ mol của dung dịch là
A. số gam chất tan trong 1 lít dung dịch.
B. số gam chất tan trong 1 lít dung môi.
C. số mol chất tan trong 1 lít dung dịch.
D. số mol chất tan trong 1 lít dung môi.
Câu 9: Với một lượng chất tan xác định khi tăng thể tích dung môi thì
A. C% tăng, CM tăng. B. C% giảm, CM giảm.
C. C% tăng, CM giảm. D. C% giảm, CM tăng.
Câu 10:Tại sao trong phòng thí nghiệm người ta lại điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3?
A. Dễ kiếm, giá thành rẻ.
B. Giàu oxi và dễ phân huỷ ra oxi.
C. Phù hợp với thiết bị máy móc hiện đại.
D. Không độc hại, dễ sử dụng.
Câu 11: Để tạo ra được 3,6 gam nước thì thể tích khí hiđro và khí oxi (ở đktc) cần tác dụng với nhau lần lượt là
A. 4,48 lít và 4,48 lít. B. 4,48 lít và 2,24 lít.
C. 2,24 lít và 4,48 lít. D. 2,24 lít và 2,24 lít.
Câu 12: Cách đọc tên nào sau đây sai?
A. CO2: cacbon (II) oxit. B. CuO: đồng (II) oxit.
C. FeO: sắt (II) oxit. D. CaO: canxi oxit.
Câu 13: Kim loại không tan trong nước là
A. Na. B. K. C. Ca. D. Cu.
Câu 14: Ở 20oC, hòa tan 20,7 gam CuSO4 vào 100 gam nước thì được một dung dịch CuSO4 bão hòa. Vậy độ tan của CuSO4 trong nước ở 20oC là
A. 120,7 gam. B. 100 gam. C. 20,7 gam. D. 20 gam.
Câu 15: Làm thế nào để dập tắt sự cháy?
A. Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy.
B. Cách li chất cháy với oxi.
C. Quạt.
D. A và B đều đúng.
Câu 16: Để pha chế được 100 ml dung dịch CuSO4 có nồng độ 2M ta thực hiện như sau:
A. Cân lấy 32 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 100 ml dung dịch.
B. Cân lấy 16 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 100 ml dung dịch.
C. Cân lấy 32 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 132 ml dung dịch.
D. Cân lấy 16 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 132 ml dung dịch.
Câu 17: Tên gọi của chất có công thức hóa học H2SO4 là
A. axit sunfuric. B. axit sunfurơ.
C. axit sunfuhiđric. D. axit lưu huỳnh.
Câu 18: Cho những biến đổi hóa học sau:
(1) Nung nóng canxi cacbonat.
(2) Sắt tác dụng với lưu huỳnh.
(3) Khí CO đi qua đồng(II) oxit nung nóng.
Những biến đổi hóa học trên thuộc loại phản ứng nào?
A. (1) và (3) là phản ứng oxi hóa – khử, (2) là phản ứng hóa hợp.
B. (1) là phản ứng phân hủy, (2) là phản ứng hóa hợp, (3) là phản ứng oxi hóa – khử.
C. (1) là phản ứng phân hủy, (2) là phản ứng oxi hóa – khử, (3) là phản ứng hóa hợp.
D. (1) là phản ứng hóa hợp, (2) và (3) là phản ứng oxi hóa – khử.
Câu 19: Oxit nào sau đây có thành phần oxi chiếm 30% về khối lượng?
A. Fe2O3. B. FeO. C. CuO. D. CaO.
Câu 20: Trong 150 ml dung dịch có hòa tan 6,39 gam Na2SO4. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
II. Tự luận
Câu 1: (2 điểm): Hoàn thành các phương trình hóa học sau:
a) PbO + H2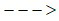 ? + ?
? + ?
b) Zn + ? 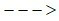 ZnSO4 + ?
ZnSO4 + ?
c) ? + HCl 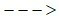 MgCl2 + ?
MgCl2 + ?
d) Fe2O3 + ?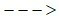 Fe + ?
Fe + ?
Câu 2 (2 điểm): Hoàn tan 9,6 gam hỗn hợp Ca và CaO vào trong nước thu được 2,24 lít khí H2 (đktc).
a) Viết phương trình hóa học các phản ứng xảy ra.
b) Tính khối lượng của mỗi chất trong hỗn hợp ban đầu.
c) Tính thành phần phần trăm khối lượng của mỗi chất trong 6 gam hỗn hợp trên.
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. Trắc nghiệm
1. D |
2. A |
3. A |
4. B |
5. A |
6. C |
7. A |
8. C |
9. B |
10. B |
11. B |
12. A |
13. D |
14. C |
15. D |
16. A |
17. A |
18. B |
19. A |
20. B |
Câu 1:
Đáp án D
Ta có: 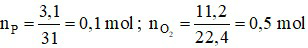
Phương trình hóa học:
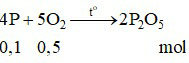
Nhận thấy: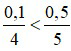 ⇒ P hết và O2 dư.
⇒ P hết và O2 dư.
⇒ Sau phản ứng, trong bình chứa khí oxi và điphotpho pentaoxit.
Câu 2:
Đáp án A
CaO tác dụng được với nước tạo thành bazơ tương ứng.
CaO + H2O ⟶ Ca(OH)2
Câu 3:
Đáp án A
Ta có: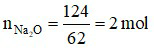
Phương trình hóa học:
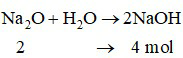
Khối lượng nước ban đầu là: m = D.V = 1.876 = 876 gam.
Bảo toàn khối lượng:
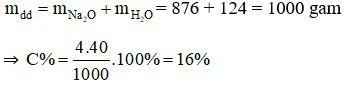
Câu 4:
Đáp án B
Rượu etylic tan vô hạn trong nước hoặc có thể nói nước tan vô hạn trong rượu etylic. Theo đề bài cho V rượu etylic (2 ml) ít hơn V nước (20 ml) nên câu diễn đạt đúng: “Rượu etylic là chất tan, nước là dung môi”.
Câu 5:
Đáp án A
Khí bay lên là H2
Số mol khí H2 là: 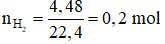
Phương trình hóa học:
2Na + 2H2O → 2NaOH + H2
Theo phương trình: 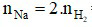 = 2.0,2 = 0,4 mol
= 2.0,2 = 0,4 mol
⇒ Khối lượng Na phản ứng là: mNa = 0,4.23 = 9,2 gam
Câu 6:
Đáp án C
Axit: H2SO3, HNO3.
Bazơ: KOH, Ca(OH)2.
Muối: FeCl3, Na2CO3, CuSO4.
Câu 7:
Đáp án A
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
⇒ Phản ứng A thuộc loại phản ứng thế.
Câu 8:
Đáp án C
Nồng độ mol của dung dịch là số mol chất tan trong 1 lít dung dịch.
Câu 9:
Đáp án B
Ta có: 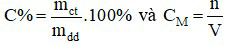
Với lượng chất tan xác định tức là mct và n không đổi.
Khi tăng thể tích dung môi ⇒ Vdd tăng và mdd tăng.
⇒ Khi này C% và CM đều giảm.
Câu 10:
Đáp án B
Trong phòng thí nghiệm, người ta lại điều chế oxi bằng cách nhiệt phân KClO3 hay KMnO4 hoặc KNO3 vì những chất này giàu oxi và dễ bị nhiệt phân hủy.
Câu 11:
Đáp án B
Phương trình hoá học: 2H2 + O2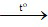 2H2O.
2H2O.
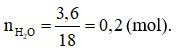
Theo phương trình hoá học:
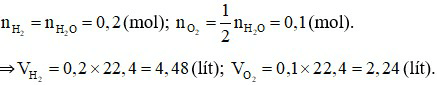
Câu 12:
Đáp án A
A sai vì CO2 đọc là cacbon đioxit.
Câu 13:
Đáp án D
Chỉ có các kim loại kiềm và kiềm thổ như: Li, Na, K, Ca, Ba… tan trong nước còn lại các kim loại khác không tan.
⇒ Cu không tan trong nước.
Câu 14:
Đáp án C
Độ tan của CuSO4 trong nước ở 20oC là:
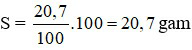
Câu 15:
Đáp án D
* Biện pháp dập tắt sự cháy
- Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy.
- Cách li chất cháy với khí oxi.
Câu 16:
Đáp án A
Số mol chất tan: 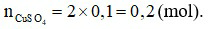
⇒ 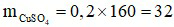 (gam).
(gam).
Cách pha chế: Cân lấy 32 gam CuSO4 vào cốc. Đổ dần dần nước cất vào cốc và khuấy nhẹ cho đủ 100 ml dung dịch.
Câu 17:
Đáp án A
H2SO4 là axit có nhiều nguyên tử oxi.
Tên axit: axit + tên phi kim + ic
⇒ Tên gọi của H2SO4 là axit sunfuric.
Câu 18:
Đáp án B
(1) CaCO3 CaO + CO2.
CaO + CO2.
⇒ (1) là phản ứng phân hủy (Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới).
(2) Fe + S FeS.
FeS.
⇒ (2) là phản ứng hóa hợp (phản ứng hóa hợp là phản ứng hóa học trong đó chỉ có một chất mới được tạo thành từ hai hay nhiều chất ban đầu).
(3) CO + CuO CO2 + CuO.
CO2 + CuO.
⇒ (3) là phản ứng oxi hóa – khử (Phản ứng oxi hóa – khử là phản ứng trong đó xảy ra đồng thời sự oxi hóa và sự khử).
Câu 19:
Đáp án A
Gọi công thức của oxit có dạng RxOy.
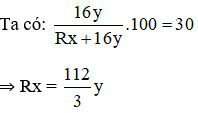
Nhận thấy: x = 2; y = 3 thì R = 56 (Fe)
⇒ Oxit cần tìm là Fe2O3.
Câu 20:
Đáp án B
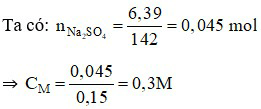
II. Tự luận
Câu 1:
a) PbO + H2 Pb + H2O
Pb + H2O
b) Zn + H2SO4 ⟶ ZnSO4 + H2↑
c) MgO + 2HCl ⟶ MgCl2 + H2O
d) Fe2O3 + 3H2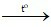 2Fe + 3H2O
2Fe + 3H2O
Câu 2:
Ta có: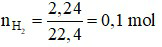
Gọi 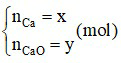
a) Phương trình hóa học:
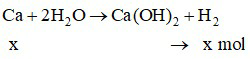
CaO + H2O ⟶ Ca(OH)2
b) Theo bài ta có hệ:
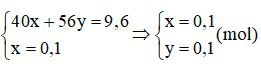
⇒ mCa = 0,1.40 = 4 gam ⇒ mCaO = 9,6 – 4 = 5,6 gam.
c) Thành phần phần trăm khối lượng của mỗi chất là:
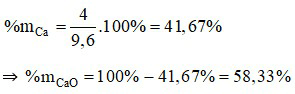
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2
năm 2025
Bài thi môn: Hóa học lớp 8
Thời gian làm bài: phút
(không kể thời gian phát đề)
(Đề số 6)
(Cho nguyên tử khối của C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5, Fe = 56, Al = 27, N = 14, S = 32, Mn = 55, Cu = 64, Zn = 65, Ag = 108, Ba = 137)
I. Trắc nghiệm (6 điểm)
Câu 1: Khí oxi không tác dụng được với chất nào sau đây?
A. Fe. B. S. C. P. D. Ag.
Câu 2: Oxit bazơ không tác dụng với nước là
A. BaO. B. Na2O. C. CaO. D. MgO.
Câu 3: Điều chế hiđro trong công nghiệp, người ta dùng:
A. Zn + HCl. B. Fe + H2SO4.
C. Điện phân nước. D. Khí dầu hỏa.
Câu 4: Cho phương trình hóa học: 2Al + Fe2O3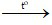 Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
Al2O3 + 3Fe. Quá trình Al tạo thành Al2O3 và quá trình Fe2O3 tạo thành Fe được gọi lần lượt là
A. sự oxi hóa, sự khử.
B. sự khử, sự oxi hóa.
C. sự phân hủy, sự khử.
D. sự oxi hóa, sự phân hủy.
Câu 5: Ở một nhiệt độ xác định, dung dịch bão hòa là dung dịch
A. không thể hòa tan thêm chất tan.
B. có thể hòa tan thêm chất tan.
C. có thể hòa tan nhiều chất tan cùng một lúc.
D. không thể hòa tan nhiều chất tan cùng một lúc.
Câu 6: Muốn điều chế được 2,8 lít khí oxi (đktc) thì khối lượng KMnO4 cần nhiệt phân là
A. 19,75 gam. B. 39,5 gam. C. 59,25 gam. D. 9,875 gam
Câu 7: Cho dung dịch HCl 25% có D = 1,198 g/ml. Tính nồng độ mol của dung dịch đã cho?
A. 8M. B. 8,2M. C. 7,9M. D. 6,5M.
Câu 8: Biết độ tan của NaCl ở 25oC là 36,2 gam. Khối lượng AgNO3 có thể tan trong 250 gam nước ở 25oC là
A. 36,2. B. 50,5. C. 62,8. D. 90,5.
Câu 9: Dãy các oxit axit là
A. SiO2, CO, CO2, P2O5, Al2O3.
B. SiO2, CO2, SO3, P2O5, N2O5.
C. FeO, CO, SO2, P2O5, Al2O3.
D. NO, CO2, CO, SiO2, P2O5.
Câu 10: Sự oxi hóa có tỏa nhiệt nhưng không phát sáng được gọi là
A. sự oxi hóa chậm. B. sự cháy.
C. sự tự bốc cháy. D. sự tỏa nhiệt.
Câu 11: Kim loại nào sau đây tác dụng mạnh với nước ở nhiệt độ thường?
A. Mg. B. Cu. C. Fe. D. Na.
Câu 12: Tên gọi của chất có công thức hóa học H2SO4 là
A. axit sunfuric. B. axit sunfurơ.
C. axit sunfuhiđric. D. axit lưu huỳnh.
Câu 13: Hòa tan 15 gam NaCl vào 55 gam nước. Nồng độ phần trăm của dung dịch là
A. 21,43%. B. 26,12%. C. 28,10%. D. 29,18%.
Câu 14: Có 3 oxit sau: MgO, P2O5, Na2O. Có thể nhận biết được các chất đó bằng thuốc thử nào sau đây?
A. Chỉ dùng nước.
B. Chỉ dùng dung dịch kiềm.
C. Chỉ dùng axit.
D. Dùng nước và giấy quỳ.
Câu 15: Cho m gam kim loại kẽm tác dụng với dung dịch HCl dư. Biết lượng khí hiđro thu được tác dụng vừa đủ với 12 gam đồng (II) oxit. Giá trị của m là
A. 7,80. B. 8,45. C. 9,10. D. 9,75.
Câu 16: Cho các bazơ sau: natri hiđroxit, bari hiđroxit, sắt (II) hiđroxit, đồng (II) hiđroxit, kali hiđroxit, nhôm hiđroxit. Số các bazơ không tan trong nước là
A. 2. B. 3. C. 4. D. 5.
Câu 17: Phản ứng nào dưới đây không phải là phản ứng thế?
A. CuO + H2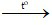 Cu + H2O
Cu + H2O
B. Mg + 2HCl → MgCl2 + H2↑
C. Ca(OH)2 + CO2 → CaCO3↓ + H2O
D. Zn + CuSO4 → ZnSO4 + Cu
Câu 18: Để pha chế được 50 gam dung dịch CuSO4 có nồng độ 10% ta thực hiện như sau:
A. hoà tan 5 gam CuSO4 vào cốc đựng 50 gam nước cất, khuấy nhẹ.
B. hoà tan 5 gam CuSO4 vào cốc đựng 45 gam nước cất, khuấy nhẹ.
C. hoà tan 8 gam CuSO4 vào cốc đựng 45 gam nước cất, khuấy nhẹ.
D. hoà tan 8 gam CuSO4 vào cốc đựng 50 gam nước cất, khuấy nhẹ.
Câu 19: Trong 200 ml dung dịch có hòa tan 8,5 gam NaNO3. Nồng độ mol của dung dịch là
A. 0,2M. B. 0,3M. C. 0,4M. D. 0,5M.
Câu 20: Độ tan của chất khí sẽ tăng nếu
A. tăng nhiệt độ và tăng áp suất.
B. tăng nhiệt độ và giảm áp suất.
C. giảm nhiệt độ và tăng áp suất.
D. giảm nhiệt độ và giảm áp suất.
II. Tự luận (4 điểm)
Câu 1 (1,5 điểm): Hoàn thành các phương trình hóa học sau:
a) Điện phân nước.
b) Khí hiđro + oxit sắt từ (Fe3O4) 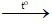 sắt + nước
sắt + nước
c) Kali clorat (KClO3) 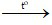 kali clorua + khí oxi.
kali clorua + khí oxi.
Câu 2 (2,5 điểm): Cho 5,4 gam nhôm phản ứng hoàn toàn với 500 ml dung dịch axit clohiđric theo sơ đồ:
Al + HCl ⟶ AlCl3 + H2↑
a) Hoàn thành phương trình hóa học của phản ứng?
Phản ứng trên thuộc loại phản ứng gì?
b) Tính thể tích khí hiđro thu được ở đktc?
c) Tính khối lượng muối nhôm clorua tạo thành sau phản ứng?
d) Tính nồng độ mol của dung dịch axit clohiđric đã dùng?
--- Hết ---
Giám thị không giải thích thêm
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I. Trắc nghiệm
1. D |
2. D |
3. C |
4. A |
5. A |
6. B |
7. B |
8. D |
9. B |
10. B |
11. D |
12. A |
13. A |
14. D |
15. D |
16. B |
17. C |
18. B |
19. D |
20. C |
Câu 1:
Đáp án D
Khí oxi tác dụng được với hầu hết các kim loại ở nhiệt độ cao trừ Ag, Au, Pt, ...
Câu 2:
Đáp án D
Oxit bazơ không tác dụng với nước là MgO.
Một số oxit bazơ tác dụng được với nước như CaO, Na2O, K2O, BaO, …
Câu 3:
Đáp án C
Điều chế hiđro trong công nghiệp, người ta dùng phương pháp điện phân nước
Câu 4:
Đáp án A
Sự tách oxi khỏi hợp chất gọi là sự khử. Sự tác dụng của oxi với một chất là sự oxi hóa. Vậy:
Quá trình Al tạo thành Al2O3 là sự oxi hóa.
Quá trình Fe2O3 tạo thành Fe là sự khử.
Câu 5:
Đáp án A
Ở một nhiệt độ xác định:
Dung dịch chưa bão hòa là dung dịch có thể hòa tan thêm chất tan.
Dung dịch bão hòa là dung dịch không thể hòa tan thêm chất tan.
Câu 6:
Đáp án B
Ta có: 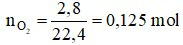
Phương trình hóa học:
2KMnO4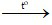 K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
Theo phương trình, ta có: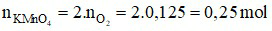
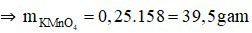
Câu 7:
Đáp án B
Đổi D = 1,198 g/ml = 1198 gam/lít
Gọi thể tích ban đầu của dung dịch HCl là V lít.
⇒ mdd = V.D = V.1198 (gam)
⇒ mHCl = V.1198.25% = 299,5V (gam)
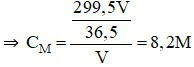
Câu 8:
Đáp án D
100 gam nước ở 25oC hòa tan tối đa được 36,2 gam NaCl.
⇒ 250 gam nước ở 25oC hòa tan tối đa được:
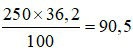 gam NaCl.
gam NaCl.
Câu 9:
Đáp án B
Oxit axit thường là oxit của phi kim như CO2, SO3, P2O5, …
Câu 10:
Đáp án B
Sự oxi hóa có tỏa nhiệt nhưng không phát sáng được gọi là sự oxi hóa chậm.
Câu 11:
Đáp án D
Một số kim loại tác dụng với nước ở nhiệt độ thường là Na, K, Ca, Ba, …
Câu 12:
Đáp án A
H2SO4 là axit có nhiều nguyên tử oxi.
Tên axit: axit + tên phi kim + ic
⇒ Tên gọi của H2SO4 là axit sunfuric.
Câu 13:
Đáp án A
mdd = 15 + 55 = 70 (gam).
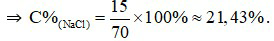
Câu 14:
Đáp án D
Lấy các mẫu thử cho vào 3 ống nghiệm có đánh số thứ tự.
- Cho ít nước vào các ống nghiệm và lắc đều thấy P2O5, Na2O tan ra tạo dung dịch đồng nhất, còn MgO không tan.
P2O5 + 3H2O → 2H3PO4
Na2O + H2O ⟶ 2NaOH
- Cho hai mẩu quỳ vào 2 ống nghiệm chứa dung dịch, ta thấy:
+ Quỳ đổi sang màu đỏ ⇒ Chất đầu là P2O5.
+ Quỳ đổi sanh màu xanh ⇒ Chất đầu là Na2O.
Câu 15:
Đáp án D
Phương trình hóa học:
Zn + 2HCl → ZnCl2 + H2↑ (1)
CuO + H2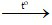 Cu + H2O (2)
Cu + H2O (2)
Câu 16:
Đáp án B
Các bazơ không tan trong nước là sắt (II) hiđroxit, đồng (II) hiđroxit, nhôm hiđroxit.
Câu 17:
Đáp án C
Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Câu 18:
Đáp án B
Khối lượng chất tan: 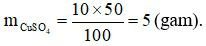
Khối lượng dung môi (nước): mdm = mdd - mct = 50 - 5 = 45 (gam).
Cách pha chế: hoà tan 5 gam CuSO4 vào cốc đựng 45 gam (hoặc 45 ml) nước cất, khuấy nhẹ.
Câu 19:
Đáp án D
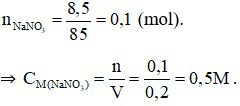
Câu 20:
Đáp án C
Độ tan của chất khí sẽ tăng nếu giảm nhiệt độ và tăng áp suất.
II. Tự luận
Câu 1:
a) 2H2O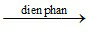 2H2↑ + O2↑
2H2↑ + O2↑
b) 4H2 + Fe3O4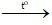 3Fe + 4H2O
3Fe + 4H2O
c) 2KClO3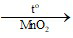 2KCl + 3O2↑
2KCl + 3O2↑
Câu 2:
a) Phương trình phản ứng:
2Al + 6HCl ⟶ 2AlCl3 + 3H2↑
⇒ Phản ứng trên thuộc loại phản ứng thế.
b) Ta có: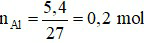
Theo phương trình: 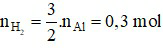
⇒ 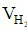 = 0,3.22,4 = 6,72 lít
= 0,3.22,4 = 6,72 lít
c) Theo phương trình: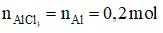
⇒ 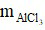 = 0,2.133,5 = 26,7 gam.
= 0,2.133,5 = 26,7 gam.
d) Theo phương trình: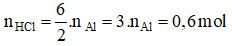
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Bộ đề thi năm 2025 các lớp các môn học được Giáo viên nhiều năm kinh nghiệm tổng hợp và biên soạn theo Thông tư mới nhất của Bộ Giáo dục và Đào tạo, được chọn lọc từ đề thi của các trường trên cả nước.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)







 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

