Giáo án KHTN 7 Kết nối tri thức Bài 6: Giới thiệu về liên kết hóa học
Giáo án KHTN 7 Kết nối tri thức Bài 6: Giới thiệu về liên kết hóa học
Chỉ từ 200k mua trọn bộ Kế hoạch bài dạy (KHBD) hay Giáo án KHTN 7 Kết nối tri thức bản word chuẩn kiến thức, trình bày đẹp mắt:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
Thời gian thực hiện: 4 tiết
I. MỤC TIÊU
1. Kiến thức
- Nêu được mô hình sắp xếp electron trong vỏ nguyên tử của một số nguyên tố khí hiếm.
- Nêu được sự hình thành liên kết cộng hoá trị theo nguyên tắc dùng chung electron để tạo ra lớp vỏ electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm (Áp dụng được cho các phân tử đơn giản như H2, Cl2, NH3, H2O, CO2, N2,….).
- Nêu được được sự hình thành liên kết ion theo nguyên tắc cho và nhận electron để tạo raion có lớp vỏ electron ngoài cùng giống nguyên tử của nguyên tố khí hiếm (Áp dụng cho phân tử đơn giản như NaCl, MgO,…).
- Xác định đượcsự khác nhau về một số tính chất của hợp chất ion và hợp chất cộng hóa trị.
2. Năng lực
2.1. Năng lực chung
- Chủ động thực hiện được những công việc của bản thân trong học tập.
- Lựa chọn và lưu giữ được thông tin bằng ghi chép, tóm tắt nội dung của bài.
- Sử dụng ngôn ngữ viết kí hiệu, tìm kiếm thông tin, đọc sách giáo khoa, quan sát tranh ảnh để tìm hiểu về liên kết hóa học.
- Hợp tác với các bạn một cách tích cực và hoàn thành nhiệm vụ của nhóm.
2.2. Năng lực khoa học tự nhiên
- Nêu được khái niệm về liên kết hóa học, liên kết ion, liên kết cộng hoá trị.
- Trình bày được số electron lớp ngoài cùng của khí hiếm.
- Vận dụng được các kiến thức kĩ năng, kĩ năng đã học để trình bày được sự hình thành liên kết ion, liên kết cộng hóa trị.
3. Phẩm chất
- Luôn cố gắng để đạt kết quả trong hoạt động học tập.
- Trung thực, cẩn thận trong thực hành, ghi chép kết quả qua hình ảnh tranh vẽ về sự hình thành phân tử thông qua liên kết hóa học.
- Thích đọc và tìm kiếm tư liệu trên mạng và các nguồn khác nhau để mở rộng hiểu biết.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Mô hình hoặc hình ảnh trong sách giáo khoa.
- Phiếu học tập theo nội dung các hoạt động.
III. TIẾN TRÌNH DẠY HỌC
TIẾT 1
A. HOẠT ĐỘNG KHỞI ĐỘNG
a) Mục tiêu
Biết được nguyên tử đứng một mình, không “kết hợp” - là các nguyên tử khí hiếm. Hầu hết các nguyên tử tồn tại ở dạng “kết hợp” các nguyên tử “giống nhau” (các nguyên tử của cùng một nguyên tố hoá học) tạo nên đơn chất. Các nguyên tử “khác nhau” (các nguyên tử không thuộc cùng một nguyên tố hoá học) kết hợp với nhau tạo nên hợp chất.
b) Nội dung
HS làm việc theo nhóm, hoàn thành phiếu học tập số 1, từ đó lĩnh hội kiến thức:
PHIẾU HỌC TẬP SỐ 1
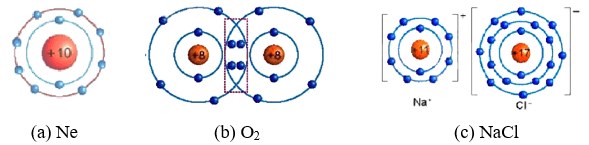
Quan sát hình ảnh sau và trả lời các câu hỏi bên dưới:
Câu 1: Hình nào là đơn chất? Hợp chất?
Câu 2: Khi tạo thành các đơn chất, hợp chất số electron lớp ngoài cùng của các nguyên tử bằng bao nhiêu?
Câu 3: Khi các nguyên tử kết hợp với nhau thứ giữ các nguyên tử lại với nhau ở dạng “kết hợp” là? Có những dạng “kết hợp” nào giữa các nguyên tử?
c) Sản phẩm
Câu trả lời của học sinh:
TRẢ LỜI PHIẾU HỌC TẬP SỐ 1
Câu 1: Hình đơn chất (a),(b).
Hợp chất (c).
Câu 2: Khi tạo thành các đơn chất, hợp chất số electron lớp ngoài cùng của các nguyên tử bằng 8 electron.
Câu 3: Khi các nguyên tử kết hợp với nhau thứ giữ các nguyên tử lại với nhau ở dạng “kết hợp” là các electron lớp ngoài cùng.
Có những dạng “kết hợp” giữa các nguyên tử: Góp chung electron gọi là liên kết cộng hóa trị và nhường, nhận electron gọi là liên kết ion.
d) Tổ chức thực hiện
Giao nhiệm vụ học tập:
- GV yêu cầu HS thảo luận theo cặp đôi (cặp đôi cùng bàn), hoàn thành phiếu học tập số 1.
- HS nhận nhiệm vụ, nêu thắc mắc nếu có.
Thực hiện nhiệm vụ học tập:
- HS thảo luận theo cặp.
- Hỗ trợ, quan sát học sinh giải đáp thắc mắc câu 1,2; dự kiến các mức độ hoàn thành nhiệm vụ theo yêu cầu câu 1,2.
Báo cáo, thảo luận:
+ Gọi nhóm trưởng thuyết trình bài của nhóm, nhóm khác nhận xét và bổ sung những ý mới của nhóm.
+ Nội dung/yêu cầu để học sinh ghi nhận là phân biệt được đơn chất và hợp chất. Số electron lớp ngoài cùng các nguyên tử trong đơn chất, hợp chất.
- Kết luận:
Vậy để hiểu kỹ hơn về sự kết hợp giữa các nguyên tử (hay liên kết hóa học) cô cùng các em nghiên cứu trong bài học ngày hôm nay: Bài 6 – Giới thiệu về liên kết hoá học.
B. HÌNH THÀNH KIẾN THỨC MỚI
|
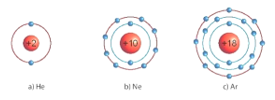
Hoạt động 1:Tìm hiểu về cấu trúc electron bền vững của khí hiếm. Mục tiêu: Nêu được mô hình sắp xếp electron trong vỏ nguyên tử của một số nguyên tố khí hiếm. | |
HOẠT ĐỘNG CỦA GV VÀ HS |
SẢN PHẨM DỰ KIẾN |
|
Giao nhiệm vụ học tập - HS thảo luận cặp đôi, hoàn thiện phiếu học tập số 2: PHIẾU HỌC TẬP SỐ 2 Biết mô hình sắp xếp electron trong vỏ nguyên tử khí hiếm sau: Dựa vào sách giáo khoa trả lời câu hỏi sau? 1/ Các mô hình He, Ne, Ar có mấy lớp electron, số electron trong các lớp? Đặc điểm số electron lớp ngoài cùng của He, Ne, Ar? 2/ Giải thích vì sao các nguyên tố khí hiếm tồn tại dưới dạng đơn nguyên tử bền vững? 3/ Giải thích vì sao: Helium trơ, rất khó cháy hay nổ, được sử dụng để bơm vào kinh khí cầu thay thế cho hydrogen (hydrogen dễ gây cháy nổ). - HS nhận nhiệm vụ. Thực hiện nhiệm vụ: HS thảo luận nhóm. Báo cáo, thảo luận: Giáo viên gọi một số nhóm trả lời câu hỏi theo từng nguyên tố He, Ne, Ar. Kết luận, nhận định: - He có 2 electron ở lớp vỏ ngoài cùng. - Ne có 8 electron ở lớp vỏ ngoài cùng. - Ar có 8 electron ở lớp vỏ ngoài cùng. - Ở điều kiện thường các khí hiếm tồn tại dưới dạng đơn nguyên tử do có lớp electron lớp ngoài cùng bền vững, khó bị biến đổi hóa học. Lớp electron ngoài cùng của chúng chứa 8 electron ( trừ He chứa 2 electron). - Nguyên tử của các nguyên tố khác có xu hướng tham gia liên kết hóa học để đạt được lớp electron ngoài cùng giống khí hiếm bằng cách nhường, nhận hay dùng chung electron vậy có những loại liên kết nào ta cung chuyến sang phần II. |
I. Cấu trúc electron bền vững của khí hiếm Sản phẩm: Câu trả lời của HS PHIẾU HỌC TẬP SỐ 1 a) He có 1 lớp electron là lớp ngoài cùng và có 2 electron bền vững. b) Ne có 2 lớp electron. Lớp thứ nhất có 2 electron, lớp thứ 2 có 8 electron. Lớp thứ 2 là lớp ngoài cùng có 8 electron đạt tới trạng thái bền vững. c) Ar có 3 lớp electron Lớp thứ nhất có 2 electron, lớp thứ 2 có 8 electron, lớp thứ 3 có 8 electron. Lớp thứ 3 là lớp ngoài cùng có 8 electron đạt tới trạng thái bền vững. 2/ Vì He có 2 electron, Ne, Ar có 8 electron. 3/ Giải thích vì khí helium là chất rất nhẹ MHe = 4 (amu) nhẹ hơn không khí rất nhiều ( MKK = 29 amu) lại có đặc điểm khó cháy hay nổ nên dùng thay thế cho hydrogen. Hydrogen tuy nhẹ hơn nhưng rất dễ gây cháy nổ. |
TIẾT 2
|
Hoạt động 2:Liên kết ion Mục tiêu:Học sinh mô tả được sự hình thành liên kết ion. | |
HOẠT ĐỘNG CỦA GV VÀ HS |
SẢN PHẨM DỰ KIẾN |
|
Giao nhiệm vụ học tập: - HS thảo luận nhóm hoàn thiện phiếu học tập số 3: PHIẾU HỌC TẬP SỐ 3 Quan sát hình 6.2– SGK trả lời các câu hỏi sau: 1/ Giải thích sự hình thành phân tử sodium chloride (NaCl)? 2/ Nêu khái niệm về liên kết ion? 3/ Giải thích kí hiệu khi viết Na, Cl, Na+, Cl-? Để tạo Na+ nguyên tử Na nhường hay nhận electron? Để tạo Cl- nguyên tử Cl nhường hay nhận electron? - HS nhận nhiệm vụ. Thực hiện nhiệm vụ: - HS thảo luận nhóm. - GV quan sát, đôn đốc và hỗ trợ HS. Báo cáo, thảo luận: + Gọi đại diện nhóm thuyết trình bài của nhóm, nhóm khác nhận xét và bổ sung những ý mới của nhóm. + Nội dung/yêu cầu để học sinh ghi nhận là phân biệt được nguyên tử và ion. Khái niệm về liên kết ion. Kết luận, nhận định: - Nguyên tử trung hòa về điện, khi nguyên tử nhường hay nhận electron, nó trở thành phần tử mang điện gọi là ion. - Điện tích của ion được viết phía trên, bên phải của kí hiệu hóa học. - Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. |
II. Liên kết ion Sự hình thành liên kết ion trong phân tử muối ăn NaCl 1/ Giải thích sự hình thành phân tử sodium chloride (NaCl): Nguyên tử natri (sodium, Na) nhường một electron ở lớp electron ngoài cùng cho nguyên tử chlorine (Cl) để tạo thành ion dương Na+ có vỏ bền vững giống vỏ nguyên tử khí hiếm Ne. Nguyên tử Cl nhận vào lớp electron ngoài cùng một electron của nguyên tử Na để tạo thành ion âm Cl- có vỏ bền vững giống vỏ nguyên tử khí hiếm Ar. Hai ion được tạo thành mang điện tích ngược dấu hút nhau để hình thành liên kết ion trong phân tử muối ăn. 2/ Liên kết ion là liên kết được hình thành bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu. 3/ Giải thích: Na là nguyên tử, Na+ là ion, dấu (+) gọi là điện tích dương viết phía trên bên phải. Cl là nguyên tử, Cl-là ion, dấu (-) gọi là điện tích âm viết phía trên bên phải. Để tạo Na+ nguyên tử Na nhường 1 electron. Để tạo Cl- nguyên tử Cl nhận 1 electron. |
|
C. HOẠT ĐỘNG LUYỆN TẬP Mục tiêu: Giải thích được sự tạo thành liên kết ion của các phân tử đơn giản: MgO; KCl … | |
HOẠT ĐỘNG CỦA GV & HS |
SẢN PHẨM DỰ KIẾN |
|
Giao nhiệm vụ học tập: - GV yêu cầu HS làm việc theo cặp, hoàn thiện câu hỏi sau: Quan sát Hình 6.3 sách giáo khoa trang 37: a) Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron? b) Mô tả sự tạo thành liên kết trong phân tử MgO. - HS nhận nhiệm vụ. Thực hiện nhiệm vụ: - HS làm việc theo cặp. - GV theo dõi, đôn đốc và hỗ trợ HS. Báo cáo, thảo luận: - Đại diện 1 nhóm HS trình bày, các nhóm khác theo dõi nhận xét. Kết luận, nhận định: - GV chuẩn hoá, chốt kiến thức. |
a) Nguyên tử Mg đã nhường 2 electron. b) Khi hình thành phân tử MgO, các nguyên tử đã có sự nhường, nhận electron như sau: + Nguyên tử Mg nhường đi 2 electron ở lớp ngoài cùng cho nguyên tử O để tạo thành ion dương Mg2+, có lớp vỏ bền vững giống vỏ khí khí hiếm Ne. + Nguyên tử O nhận vào lớp electron ngoài cùng 2 electron của nguyên tử Mg để tạo thành ion âm O2- có lớp vỏ ngoài cùng bền vững giống khí hiếm Ne. Hai ion sinh ra mang điện tích trái dấu, hút nhau tạo nên hợp chất MgO. |
TIẾT 3
|
Hoạt động 3:Liên kết cộng hoá trị trong phân tử đơn chất. Mục tiêu: Học sinh mô tả được sự hình thành liên kết cộng hoá trị trong các phân tử đơn chất H2, O2… | |
HOẠT ĐỘNG CỦA GV VÀ HS |
SẢN PHẨM DỰ KIẾN |
|
Giao nhiệm vụ học tập: - Chia nhóm ít nhất 4 hs/1nhóm. Nhóm chẵn tìm hiểu về sự hình thành phân tử hydrogen (H2); Nhóm lẻ tìm hiểu về sự hình thành phân tử oxygen (O2). PHIẾU HỌC TẬP SỐ 4. Nhóm chẵn. Sự hình thành phân tử hydrogen Quan sát hình 6.4- SGK trả lời các câu hỏi sau: 1/ Số electron lớp ngoài cùng của H trước và sau khi tạo thành liên kết cộng hóa trị? 2/ Số electron lớp vỏ của H sau khi tạo thành liên kết cộng hóa trị giống với nguyên tố khí hiếm nào? 3/ Nêu khái niệm về liên kết cộng hóa trị? Nhóm lẻ. Sự hình thành phân tử oxygen: Quan sát hình 6.5 - SGK trả lời các câu hỏi sau: 1/ Số electron lớp ngoài cùng của O trước và sau khi tạo thành liên kết cộng hóa trị? 2/ Số electron lớp vỏ của của O sau khi tạo thành liên kết cộng hóa trị giống với nguyên tố khí hiếm nào? 3/ Nêu khái niệm về liên kết cộng hóa trị? - HS nhận nhiệm vụ. Thực hiện nhiệm vụ: - HS thảo luận nhóm. - GV đôn đốc và hỗ trợ HS. Báo cáo, thảo luận: + Gọi nhóm trưởng thuyết trình bài của nhóm, nhóm khác nhận xét và bổ sung những ý mới của nhóm. + Nội dung/yêu cầu để học sinh ghi nhận là số electron của các nguyên tử trước và sau khi tạo thành liên kết cộng hóa trị. Kết luận, nhận định: + Các nguyên tử riêng rẽ của các nguyên tố hydrogen và oxygen không bền vững,chúng có xu hướng kết hợp với nguyên tử khác bằng liên kết cộng hoá trị để hìnhthành các phân tử. Các nguyên tử trong phân tử đạt cấu hình electron lớp ngoài cùng bền vững. + Liên kết được hình thành trong phân tử hydrogen và oxygen là liên kết cộng hoá trị và hydrogen, oxygen được gọi làchất cộng hoá trị. + Cácchất cộng hoá trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp. |
III. Tìm hiểu về liên kết cộng hoá trị 1. Liên kết cộng hoá trị trong phân tử đơn chất. PHIẾU HỌC TẬP SỐ 4 Nhóm chẵn: Quan sát hình 6.4ta thấy: 1/ Số electron lớp ngoài cùng của H trước khi hình thành liên kết là 1 electron và sau khi tạo thành liên kết cộng hóa trị là 2 electron. 2/ Số electron lớp ngoài cùng của H sau khi tạo thành liên kết cộng hóa trị giống với nguyên tố khí hiếm He. 3/ Nêu khái niệm về liên kết cộng hóa trị: Liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một haynhiều cặp electron dùng chung. Nhóm lẻ. Quan sát hình 6.5 ta thấy: 1/ Số electron lớp ngoài cùng của O trước khi hình thành liên kết là 6 electron và sau khi tạo thành liên kết cộng hóa trị là 8 electron. 2/ Số electron của O sau khi tạo thành liên kết cộng hóa trị giống với lớp vỏ của nguyên tố khí hiếm Ne. 3/ Nêu khái niệm về liên kết cộng hóa trị: Liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một haynhiều cặp electron dùng chung. |
|
Hoạt động 4: Liên kết cộng hoá trị trong phân tử hợp chất Mục tiêu:Học sinh mô tả được sự hình thành liên kết cộng hoá trị trongsự hình thành phân tử nước. | |
HOẠT ĐỘNG CỦA GV VÀ HS |
SẢN PHẨM DỰ KIẾN |
|
Giao nhiệm vụ học tập: - GV yêu cầu HS thảo luận cặp đôi hoàn thành phiếu học tập số 5: PHIẾU HỌC TẬP SỐ 5 Quan sát hình 6.6 – SGK, kết hợp với sách giáo khoa trả lời câu hỏi sau: 1/ Số electron lớp ngoài cùng của H và O trước và sau khi tạo thành liên kết cộng hóa trị? 2/ Số electron của H và O sau khi tạo thành liên kết cộng hóa trị giống với lớp vỏ của các nguyên tố khí hiếm nào? 3/ Các chất cộng hóa trị tồn tại ở những trạng thái nào? - HS nhận nhiệm vụ. Thực hiện nhiệm vụ: - HS thảo luận cặp đôi. - GV đôn đốc và hỗ trợ HS. Báo cáo, thảo luận: Gọi cá nhân xung phong lên trả lời câu hỏi từng câu hỏi. Kết luận, nhận định: Liên kết được hình thành trong phân tử hydrogen và oxygen là liên kết cộng hoá trị.Vậy, liên kết cộng hoá trị là liên kết được tạo nên giữa hai nguyên tử bằng một haynhiều cặp electron dùng chung. Liên kết cộng hoá trị thường gặp trong nhiều phân tửđơn chất phi kim như nitrogen, chlorine, fluorine,... |
2. Liên kết cộng hoá trị trong phân tử hợp chất 1/ Số electron lớp ngoài cùng của H trước là 1 electron và sau khi tạo thành liên kết cộng hóa trị là 2 electron. Số electron lớp ngoài cùng của O trước là 6 electron và sau khi tạo thành liên kết cộng hóa trị là 8 electron. 2/ Số electron lớp ngoài cùng của H sau khi tạo thành liên kết cộng hóa trị giống với nguyên tố khí hiếm He. Số electron của O sau khi tạo thành liên kết cộng hóa trị giống với lớp vỏ của nguyên tố khí hiếm Ne. 3/ Các chất cộng hoá trị có thể là chất khí, chất lỏng hay chất rắn. Cácchất cộng hoá trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp. |
TIẾT 4
C. HOẠT ĐỘNG LUYỆN TẬP
a) Mục tiêu
Củng cố lại các phần đã học trong phần hình thành kiến thức mới về liên kết ion, liên kết cộng hóa trị.
b) Nội dung
HS hoạt động theo cặp hoàn thiện các bài tập sau:
BÀI TẬP TỰ LUẬN:
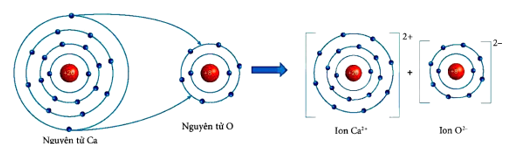
Câu 1: Hãy vẽ sơ đồ mô tả sự hình thành liên kết ion giữa calcium và oxygen.
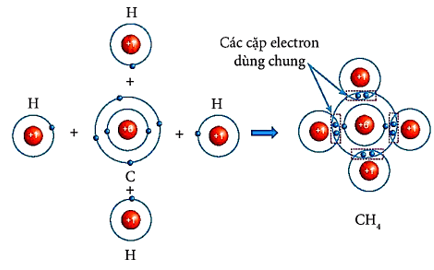
Câu 2: Hãy vẽ sơ đồ mô tả sự hình thành liên kết cộng hoá trị trong phân tử CH4.
Câu 3:
a) Điển các thông tin còn thiếu để hoàn thành bảng sau về các kim loại.
Nguyên tố |
Na |
Mg |
AI |
Số thứtựcủa nhóm trong bảng tuần hoàn. |
|||
Số electron ở lớp ngoài cùng. |
|||
Sổ electron nhường đi để đạt được lớp electron |
|||
Điện tích ion tạo thành. |
b) Hãy nhận xét về số thứ tự của nhóm trong bảng tuần hoàn và điện tích của
các ion kim loại tạo thành.
BÀI TẬP TRẮC NGHIỆM
Câu 1. Số electron ở lớp ngoài cùng của nguyên tử khí hiếm (trừ He) là
A. 1.
B. 3.
C. 5.
D. 8.
Câu 2. Khi hình thành phân tử NaCl, nguyên tử Na
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Câu 3. Khi hình thành phân tử NaCl, nguyên tử Cl
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Câu 4. Khi hình thành phân tử MgO, nguyên tử Mg
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Câu 5. Khi hình thành phân tử MgO, nguyên tử O
A. nhường 1 electron.
B. nhận 1 electron.
C. nhường 2 electron.
D. nhận 2 electron.
Câu 6. Số cặp electron dùng chung giữa các nguyên tử trong phân tử H2O là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 7. Số cặp electron dùng chung trong phân tử oxygen là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 8. Số cặp electron dùng chung giữa các nguyên tử trong phân tử ammonia (NH3) là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 9. Số cặp electron dùng chung giữa các nguyên tử trong phân tử CO2 là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 10. Cho các phân tử sau: KCl, CaO, N2, Cl2, HCl. Số phân tử có chứa liên kết cộng hoá trị là
A. 1.
B. 2.
C. 3.
D. 4.
c) Sản phẩm:
Các câu trả lời của HS:
PHẦN TỰ LUẬN:
Câu 1: Sơ đồ mô tả sự hình thành liên kết ion giữa calcium và oxygen.
Nguyên tử Ca nhường 2 electron ở lớp ngoài cùng của nó cho nguyên tử O tạo thành các ion Ca2+ và O2-, các ion này mang điện tích trái dấu hút nhau.
Câu 2: Sơ đồ mô tả sự hình thành liên kết cộng hoá trị trong phân tử CH4:
Câu 3:
a) Điển các thông tin còn thiếu:
Nguyên tố |
Na |
Mg |
AI |
Số thứtựcủa nhóm trong bảng tuần hoàn |
I |
II |
III |
Số electron ở lớp ngoài cùng |
1 |
2 |
3 |
Sổ electron nhường đi để đạt được lớp electron |
1 |
2 |
3 |
Điện tích ion tạo thành |
1+ |
2+ |
3+ |
b) Số thứ tự của nhóm trong bảng tuần hoàn bằng số điện tích củacác ion kim loại tạo thành.
PHẦN TRẮC NGHIỆM
1 – D; 2 – A; 3 – B; 4 – C; 5 – D; 6 – B; 7 – B; 8 – C; 9 – D; 10 – C.
d) Tổ chức thực hiện:
Giao nhiệm vụ học tập:
- GV yêu cầu HS thảo luận theo cặp đôi (cùng bàn) hoàn thành các bài tập.
- HS nhận nhiệm vụ.
Thực hiện nhiệm vụ:
- HS thảo luận và làm bài tập.
- GV đôn đốc và hỗ trợ HS.
Báo cáo:
- Cử đại diện HS lên trình bày (mỗi HS trình bài 1 bài tập). Các HS khác nhận xét, bổ sung.
Kết luận:
- GV chuẩn hoá, chốt kiến thức.
D. HOẠT ĐỘNGVẬN DỤNG
a) Mục tiêu
HS vận dụng được các kiến thức về liên kết hoá học để giải thích các hiện tượng thực tiễn đời sống.
b) Nội dung
HS làm việc cá nhân, tại nhà hoàn thành câu hỏi vận dụng sau:
Vận dụng khái niệm liên kết hóa học để giải thích được vì sao trong tự nhiên, muối ăn ở trạng thái rắn, khó nóng chảy, khó bay hơi, còn đường ăn, nước đá ở thể rắn dễ nóng chảy và nước ở thể lỏng dễ bay hơi?
c) Sản phẩm
Câu trả lời của HS:
- Muối ăn là hợp chất ion nên là chất rắn ở điều kiện thường, khó bay hơi, khó nóng chảy.
- Đường ăn và nước đá là hợp chất cộng hóa trị nên ở thể rắn, dễ nóng chảy và nước ở thể lỏng sẽ dễ bay hơi do các chất cộng hóa trị thường có nhiệt độ nóng chảy và nhiệt độ sôi thấp.
d) Tổ chức thực hiện:
- GV yêu cầu học sinh hoàn thiện câu hỏi tại nhà.
- HS hoàn thiện tại nhà.
................................
................................
................................
Trên đây tóm tắt một số nội dung miễn phí trong bộ Kế hoạch bài dạy (KHBD) hay Giáo án Khoa học tự nhiên 7 Kết nối tri thức năm 2026 mới nhất, để mua tài liệu đầy đủ, Thầy/Cô vui lòng:
Xem thêm các bài soạn Giáo án Khoa học tự nhiên lớp 7 Kết nối tri thức chuẩn khác:
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giáo án KHTN 7 mới, chuẩn nhất của chúng tôi được biên soạn bám sát mẫu giáo án Khoa học tự nhiên 7 chuẩn của cả ba bộ sách mới.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giáo án lớp 7 (các môn học)
- Giáo án điện tử lớp 7 (các môn học)
- Giáo án Toán 7
- Giáo án Ngữ văn 7
- Giáo án Tiếng Anh 7
- Giáo án Khoa học tự nhiên 7
- Giáo án Lịch Sử 7
- Giáo án Địa Lí 7
- Giáo án GDCD 7
- Giáo án Tin học 7
- Giáo án Công nghệ 7
- Giáo án HĐTN 7
- Giáo án Hoạt động trải nghiệm 7
- Giáo án Vật Lí 7
- Giáo án Sinh học 7
- Giáo án Hóa học 7
- Giáo án Âm nhạc 7
- Đề thi lớp 7 (các môn học)
- Đề thi Ngữ Văn 7 (có đáp án)
- Chuyên đề Tiếng Việt lớp 7
- Đề thi Toán 7 (có đáp án)
- Đề cương ôn tập Toán 7
- Đề thi Tiếng Anh 7 (có đáp án)
- Đề thi Khoa học tự nhiên 7 (có đáp án)
- Đề thi Lịch Sử & Địa Lí 7 (có đáp án)
- Đề thi Địa Lí 7 (có đáp án)
- Đề thi Lịch Sử 7 (có đáp án)
- Đề thi GDCD 7 (có đáp án)
- Đề thi Công nghệ 7 (có đáp án)
- Đề thi Tin học 7 (có đáp án)




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

