Lý thuyết Liên kết cộng hóa trị (Hóa 10 Cánh diều Bài 11)
Với tóm tắt lý thuyết Hóa học 10 Bài 11: Liên kết cộng hóa trị sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Liên kết cộng hóa trị (Hóa 10 Cánh diều Bài 11)
I. Liên kết cộng hóa trị
Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
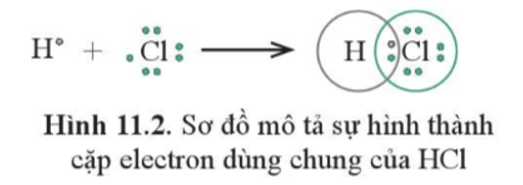
Ví dụ 1: Nguyên tử hydrogen (H) có cấu hình electron 1s1, chlorine (Cl) có cấu hình electron [Ne]3s23p5.
Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron chung cho cả hai nguyên tử.
Nhận xét:
- Liên kết giữa nguyên tử H và Cl được tạo nên bởi 1 cặp electron chung. Công thức 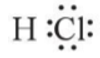
- Nếu giữa hai nguyên tử chỉ có một cặp electron chung thì cặp electron này được biểu diễn bằng một nối đơn (–). Khi đó, HCl được biểu diễn như sau: 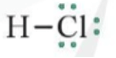
Như vậy, công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết (cặp electron chung) và các electron riêng.
- Hợp chất HCl được tạo nên chỉ bởi liên kết cộng hóa trị nên thuộc loại hợp chất cộng hóa trị.
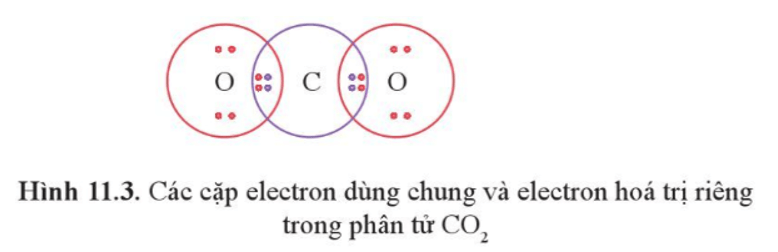
Ví dụ 2: Công thức cấu tạo của CO2 là O = C = O.
Nếu giữa hai nguyên tử có hai cặp electron chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
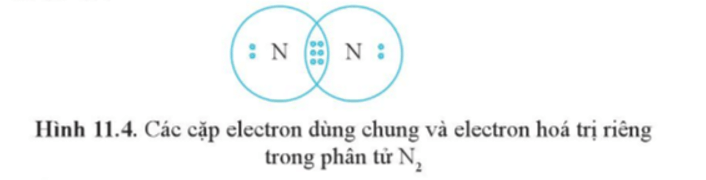
Ví dụ 3: Công thức cấu tạo của N2 là NN.
Nếu giữa hai nguyên tử có ba cặp electron chung thì ba cặp electron này được biểu diễn bằng một nối ba () và gọi là liên kết ba.
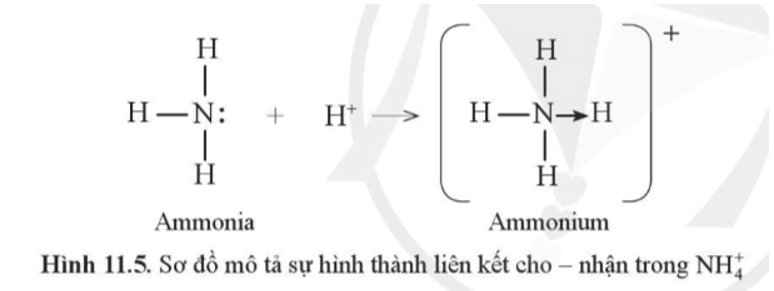
Ví dụ 4: Phân tử ammonia kết hợp với ion H+ tạo ra cation ammonium ().
Trên nguyên tử N còn 1 cặp electron riêng, khi hình thành , cặp electron này trở thành cặp electron chung cho cả N và H, cả N và các nguyên tử H đều thỏa mãn quy tắc octet. Như vậy, liên kết đơn giữa nguyên tử N trong NH3 và H+ được tạo thành bởi một cặp electron góp chung của nguyên tử N.
Để chỉ rõ sự khác biệt về nguồn gốc cặp electron chung, liên kết tạo bởi cặp electron của N và ion H+ được kí hiệu là mũi tên ( ) xuất phát từ N. Loại liên kết này được gọi là liên kết cho nhận.
Liên kết cho nhận là liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
II. Phân loại liên kết theo độ âm điện
Sự khác biệt về hiệu độ âm điện 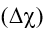
Quy tắc phân loại liên kết theo độ âm điện:
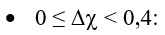
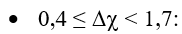
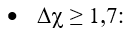
Chú ý: Có một số trường hợp ngoại lệ không tuân theo quy tắc trên như: hợp chất cộng hóa trị HF, hợp chất ion MnI2…
Ví dụ 1: Xét phân tử Cl2.
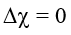
Ví dụ 2: Xét phân tử HCl.
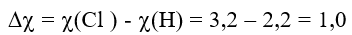
Ví dụ 3: Xét phân tử NaCl.
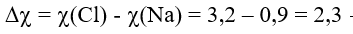
III. Liên kết sigma () và liên kết pi ()
Để tạo nên một cặp electron chung, hai AO chứa electron độc thân (hoặc giữa 1 AO trống và 1 AO bão hòa electron) cần xen phủ với nhau.
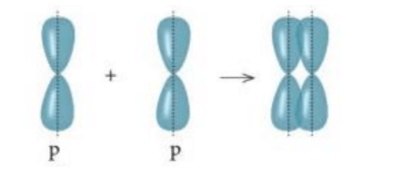
Xét sự xen phủ của AOs và AOp, có hai kiểu xen phủ AO là xen phủ trục và xen phủ bên.
1. Xen phủ trục là xen phủ giữa hai AO dọc theo trục nối (trục z) hai nguyên tử. Có 3 khả năng xen phủ trục:
- Xen phủ giữa AO s với AO s:
- Xen phủ giữa AO s với AO p:
- Xen phủ giữa AO p với AO p:
Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma ().
2. Xen phủ bên là sự xen phủ xảy ra giữa hai AO p song song với nhau.
Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi ().
Liên kết đơn còn gọi là liên kết , liên kết đôi gồm một liên kết và một liên kết , liên kết ba gồm một liên kết và hai liên kết .
IV. Năng lượng của liên kết cộng hóa trị
Năng lượng liên kết là năng lượng cần thiết để phá vỡ một loại liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar. Đơn vị của năng lượng liên kết thường là kJ mol-1. Năng lượng liên kết càng lớn, liên kết đó càng bền.
Ví dụ 1: Để phá vỡ liên kết H – H trong 1 mol khí H2 ở 25oC và 1 bar cần năng lượng là 436 kJ.
Ví dụ 2: Năng lượng liên kết của H – H là 436 kJ mol-1, của H – I là 297 kJ mol-1. Như vậy, liên kết H – H bền hơn liên kết H – I.
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Cánh diều hay khác:
- Lý thuyết Hóa 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
- Lý thuyết Hóa 10 Bài 13: Phản ứng oxi hóa – khử
- Lý thuyết Hóa 10 Bài 14: Phản ứng hóa học và enthalpy
- Lý thuyết Hóa 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
- Lý thuyết Hóa 10 Bài 16: Tốc độ phản ứng hóa học
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

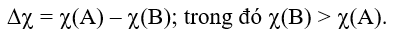






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

