Lý thuyết Nguyên tố và đơn chất halogen (Hóa 10 Cánh diều Bài 17)
Với tóm tắt lý thuyết Hóa học 10 Bài 17: Nguyên tố và đơn chất halogen sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Nguyên tố và đơn chất halogen (Hóa 10 Cánh diều Bài 17)
I. Giới thiệu về nguyên tố nhóm VIIA
Nguyên tố nhóm VIIA gồm: fluorine, chlorine, bromine, iodine và hai nguyên tố phóng xạ là astatine, tennessine.
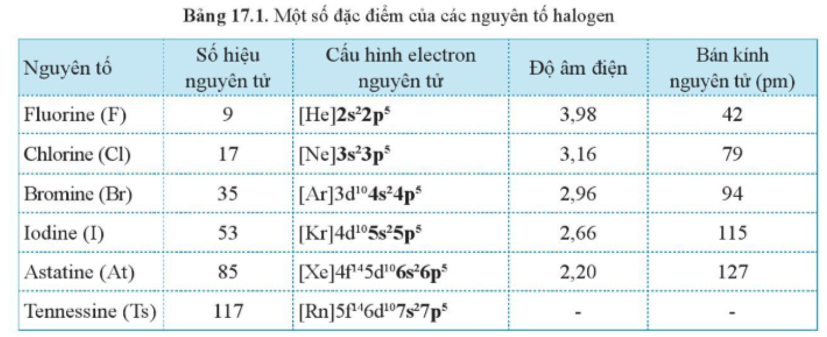
Một số đặc điểm của nguyên tố halogen.
Nhận xét:
- Mỗi nguyên tử nguyên tố nhóm VIIA đều có 7 electron lớp ngoài cùng, dạng ns2np5. Vì vậy, chúng là các phi kim.
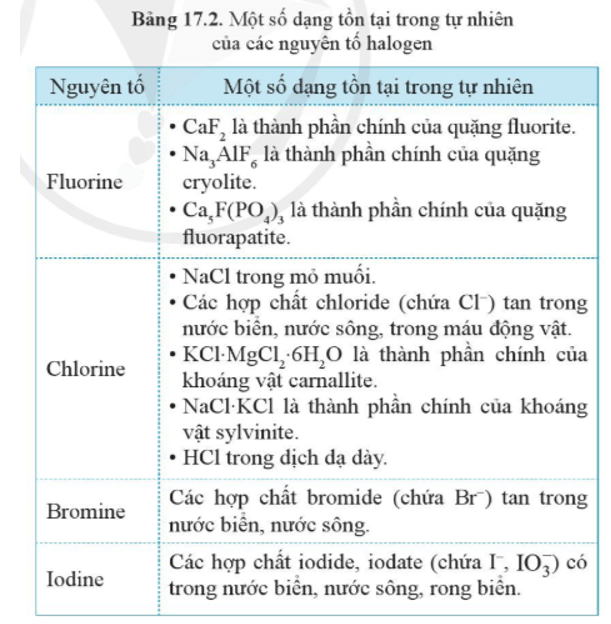
- Trong tự nhiên, các nguyên tố nhóm VIIA chủ yếu tồn tại ở dạng muối, do đó chúng còn được gọi là nhóm halogen.
II. Đơn chất halogen
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng phân tử hai nguyên tử, được kí hiệu chung là X2.
1. Xu hướng biến đổi một số tính chất vật lí
a) Nhiệt độ sôi, nhiệt độ nóng chảy
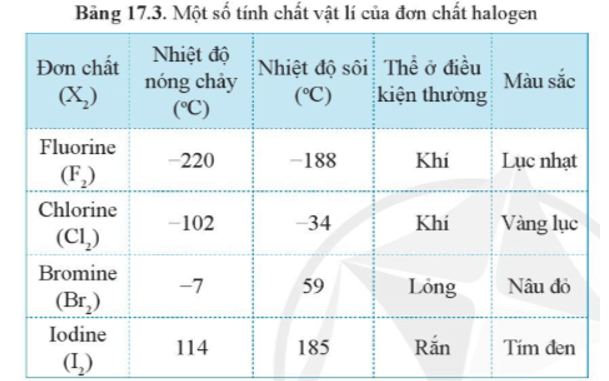
- Từ fluorine đến iodine, nhiệt độ sôi và nhiệt độ nóng chảy tăng dần.
- Giải thích: Khi phân tử X2 có kích thước càng lớn và càng nhiều electron thì tương tác van der Waals giữa các phân tử càng mạnh. Do đó, trong các halogen, tương tác van der Waals tăng từ fluorine đến iodine. Như vậy, bên cạnh sự tăng khối lượng phân tử, sự tăng tương tác van der Waals làm cho nhiệt độ sôi tăng dần từ fluorine đến iodine.
b) Thể ở điều kiện thường
Thể của các halogen ở điều kiện thường biến đổi từ khí (fluorine, chlorine) đến lỏng (bromine) và rắn (iodine), phù hợp với xu hướng tăng khối lượng phân tử và sự tương tác giữa các phân tử.
c) Màu sắc
Màu sắc của các đơn chất halogen từ fluorine đến iodine cũng biến đổi theo xu hướng đậm dần: F2 màu lục nhạt, Cl2 màu vàng lục, Br2 màu nâu đỏ, I2 màu tím đen.
2. Xu hướng tạo liên kết trong các phản ứng hóa học
Nguyên tử các nguyên tố halogen đều có 7 electron hóa trị. Vì vậy, theo quy tắc octet, halogen thường có hai xu hướng tạo liên kết khi phản ứng với các chất khác.
Xu hướng thứ nhất: nhận thêm 1 electron từ nguyên tử khác. Xu hướng này xảy ra khi đơn chất halogen phản ứng với nhiều kim loại khác nhau. Khi đó, mỗi nguyên tử X nhận thêm 1 electron từ nguyên tử kim loại để trở thành anion có điện tích 1–, đồng thời nguyên tử kim loại sẽ trở thành cation có điện tích n+ để cùng thỏa mãn quy tắc octet. Giữa chúng sẽ có tương tác tĩnh điện để tạo hợp chất có liên kết ion.
Ví dụ 1: Khi chlorine phản ứng với magnesium, có sự nhường và nhận electron như sau:
Cl2 + 2e 2Cl-
Mg Mg2+ + 2e
Phương trình hóa học của phản ứng là: Mg(s) + Cl2(g) MgCl2(s).
Xu hướng thứ hai: góp chung electron hóa trị với nguyên tử nguyên tố khác. Khi đơn chất halogen phản ứng với một số phi kim thì mỗi nguyên tử X có thể góp chung electron hóa trị với nguyên tử phi kim để cả hai nguyên tử đều đạt cấu hình electron thỏa mãn quy tắc octet. Giữa chúng hình thành liên kết cộng hóa trị.
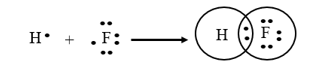
Ví dụ 2: Phản ứng giữa fluorine và hydrogen, nguyên tử của mỗi chất sẽ góp chung 1 electron độc thân để hình thành một liên kết cộng hóa trị. Khi đó, quanh H có 2 electron như khí hiếm helium, xung quanh F có 8 electron như khí hiếm neon, với mô tả theo công thức electron:
Phương trình hóa học của phản ứng: H2(g) + F2(g) 2HF(g).
Kết luận:
- Nhóm halogen có tính phi kim mạnh hơn các nhóm phi kim còn lại trong bảng tuần hoàn.
- Hóa trị phổ biến của các halogen là I.
3. Xu hướng thể hiện tính oxi hóa
Ngoại trừ fluorine, các halogen còn lại thể hiện cả tính oxi hóa và tính khử trong các phản ứng hóa học. Tuy nhiên, xu hướng thể hiện tính oxi hóa phổ biến hơn rất nhiều và trở nên đặc trưng hơn so với xu hướng thể hiện tính khử.
a) Phản ứng với hydrogen
Mức độ phản ứng với hydrogen giảm từ fluorine đến iodine, phù hợp với xu hướng giảm tính oxi hóa của dãy halogen từ fluorine đến iodine.
b) Phản ứng thế halogen
Trong dung dịch, các halogen có tính oxi hóa mạnh hơn sẽ phản ứng với muối halide của halogen có tính oxi hóa yếu hơn để tạo ra các halogen có tính oxi hóa yếu hơn.
Ví dụ: Cl2(aq) + 2NaBr(aq) 2NaCl(aq) + Br2(aq).
Chú ý: Trong dung dịch, fluorine không có phản ứng trên. Đó là do fluorine ưu tiên phản ứng với nước.
c) Phản ứng với nước, với dung dịch sodium hydroxide
Khi cho các halogen vào nước thì fluorine phản ứng mạnh, chlorine và bromine có phản ứng thuận nghịch với nước, còn iodine tan rất ít và hầu như không phản ứng.
Chú ý:
- Phản ứng giữa chlorine và nước là thuận nghịch tạo ra dung dịch gồm nước, hydrochloric acid (HCl), hypochlorous acid (HClO, còn được viết là HOCl) cùng chlorine. Dung dịch này còn được gọi là dung dịch nước chlorine, có tính sát khuẩn. Vì vậy, nước chlorine được sử dụng để xử lí vi khuẩn trong các nguồn nước cấp hoặc xử lí môi trường.
- Trong công nghiệp, người ta còn sử dụng phản ứng giữa chlorine với dung dịch sodium hydroxide lạnh (khoảng 15oC) để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích sát khuẩn:
Nhận xét: Số oxi hóa của Cl2 vừa tăng (từ 0 lên +1), vừa giảm (từ 0 xuống – 1), do đó Cl2 vừa là chất oxi hóa, vừa là chất khử. Phản ứng (*) là loại phản ứng tự oxi hóa, tự khử.
Phản ứng (*) còn được thực hiện ở 70oC: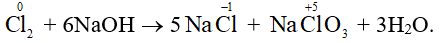
- Ngoại trừ fluorine, các halogen còn lại khi phản ứng với nước hoặc dung dịch sodium hydroxide (NaOH) đều thể hiện cả tính oxi hóa và tính khử.
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Cánh diều hay khác:
- Lý thuyết Hóa 10 Bài 13: Phản ứng oxi hóa – khử
- Lý thuyết Hóa 10 Bài 14: Phản ứng hóa học và enthalpy
- Lý thuyết Hóa 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
- Lý thuyết Hóa 10 Bài 16: Tốc độ phản ứng hóa học
- Lý thuyết Hóa 10 Bài 18: Hydrogen halide và hydrohalic acid
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều


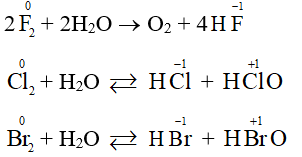
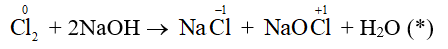



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

