Lý thuyết Lớp, phân lớp và cấu hình electron (Hóa 10 Cánh diều Bài 5)
Với tóm tắt lý thuyết Hóa học 10 Bài 5: Lớp, phân lớp và cấu hình electron sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Lớp, phân lớp và cấu hình electron (Hóa 10 Cánh diều Bài 5)
I. Lớp và phân lớp electron
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo năng lượng của chúng.
1. Lớp electron
Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
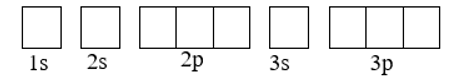
Số electron và số AO trong lớp electron thứ n (n ≤ 4) được ghi nhớ theo quy tắc sau:
- Lớp thứ n có n2 AO.
- Lớp thứ n có tối đa 2n2 electron.
Ví dụ: Lớp thứ hai (lớp L, n = 2):
- Có n2 = 22 = 4 AO.
- Có tối đa 2n2 = 2×22 = 8 electron.
2. Phân lớp electron
- Mỗi lớp electron (trừ lớp thứ nhất) lại được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
- Số lượng và kí hiệu các phân lớp trong một lớp:
Lớp thứ n có n phân lớp và kí hiệu lần lượt là ns, np, nd, nf, … Cụ thể:
+ Lớp K, n = 1: có 1 phân lớp , kí hiệu là 1s.
+ Lớp L, n = 2: có 2 phân lớp, kí hiệu là 2s và 2p.
+ Lớp M, n = 3: có 3 phân lớp, kí hiệu là 3s, 3p và 3d.
- Số lượng AO trong mỗi phân lớp:
+ Phân lớp ns chỉ có 1 AO.
+ Phân lớp np có 3 AO.
+ Phân lớp nd có 5 AO.
+ Phân lớp nf có 7 AO.
- Số electron trong mỗi phân lớp được biểu diễn bằng chỉ số phía trên, bên phải kí hiệu phân lớp. Phân lớp nào đã có tối đa electron thì được gọi là phân lớp bão hòa.
Ví dụ: Kí hiệu 1s2 cho biết phân lớp 1s có 2 electron. Do phân lớp 1s chỉ có 1 AO nên phân lớp này chứa tối đa 2 electron, 1s2 được gọi là phân lớp bão hòa electron.
II. Cấu hình electron nguyên tử
1. Cách viết cấu hình electron nguyên tử
Cấu hình electron biểu diễn sự phân bố electron vào lớp vỏ nguyên tử theo các lớp và phân lớp.
Các bước viết cấu hình electron nguyên tử theo những quy tắc sau:
- Quy tắc 1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski):
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, …
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
Chú ý: Quy tắc đường chéo xác định dãy Klechkovski (Klếch-cốp-ski) như sau:
- Quy tắc 2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải.
Ví dụ 1: Nguyên tử Li có Z = 3.
- Thứ tự các mức năng lượng: 1s22s1.
1s22s1 cũng chính là cấu hình electron của Li vì trường hợp này không cần sử dụng đến quy tắc 2.
Ví dụ 2: Nguyên tử K có Z = 19.
- Thứ tự các mức năng lượng: 1s22s22p63s23p64s1.
Cấu hình electron của nguyên tử K: 1s22s22p63s23p64s1.
Chú ý: Cấu hình electron của nguyên tử K có thể viết gọn là [Ar]4s1; kí hiệu [Ar] thay cho cấu hình nguyên tử khí hiếm Ar là 1s22s22p63s23p6.
Ví dụ 3: Nguyên tử Fe có Z = 26.
- Thứ tự các mức năng lượng: 1s22s22p63s23p64s23d6.
Cấu hình electron của nguyên tử Fe: 1s22s22p63s23p63d64s2 hoặc [Ar] 3d64s2.
Chú ý: Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng electron trên mỗi phân lớp tăng theo chiều từ trái qua phải.
Ví dụ 4: Trong nguyên tử Li (Z = 3) có cấu hình electron 1s22s1, năng lượng của electron thuộc phân lớp 2s cao hơn electron thuộc phân lớp 1s.
2. Biểu diễn cấu hình electron theo ô orbital
- Biểu diễn cấu hình electron theo ô obital (còn gọi là cách biểu diễn cấu hình theo ô lượng tử) là một cách biểu diễn sự phân bố electron theo orbital, từ đó biết được số electron độc thân của nguyên tử.
- Quy tắc biểu diễn cấu hình theo orbital:
+ Viết cấu hình electron của nguyên tử.
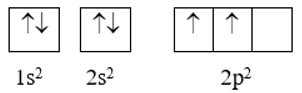
+ Biểu diễn mỗi AO bằng một ô vuông (ô orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
- Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên. Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các ô orbital theo thứ tự từ trái sang phải. Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên đi xuống.
Ví dụ: Cấu hình theo ô orbital của C (Z = 6) như sau:
Như vậy, nguyên tử carbon có 2 electron độc thân, thuộc AO 2p.
III. Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron
Từ cấu hình electron của nguyên tử, có thể dự đoán được tính chất hóa học cơ bản của nguyên tố hóa học (tính kim loại, tính phi kim, tính trơ, …) theo quy tắc:
- Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố kim loại. Tính kim loại thể hiện qua khả năng nhường electron trong các phản ứng hóa học (tính khử).
- Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim. Tính phi kim thể hiện qua khả năng nhận electron trong các phản ứng hóa học (tính oxi hóa).
- Các nguyên tử có 8 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố khí hiếm (trừ He chỉ có 2 electron). Các nguyên tố này rất khó tham gia các phản ứng hóa học (tính trơ).
- Nếu lớp electron ngoài cùng có 4 electron thì nguyên tử nguyên tố có thể là kim loại hoặc phi kim.
Ví dụ: Nguyên tử nguyên tố X có Z = 11.
Cấu hình electron của nguyên tử X: 1s22s22p63s1.
Nguyên tử X có 1 electron ở lớp ngoài cùng X là nguyên tử nguyên tố kim loại.
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Cánh diều hay khác:
- Lý thuyết Hóa 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Lý thuyết Hóa 10 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
- Lý thuyết Hóa 10 Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Lý thuyết Hóa 10 Bài 9: Quy tắc octet
- Lý thuyết Hóa 10 Bài 10: Liên kết ion
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

