Lý thuyết Phản ứng oxi hóa khử (Hóa 10 Cánh diều Bài 13)
Với tóm tắt lý thuyết Hóa học 10 Bài 13: Phản ứng oxi hóa – khử sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Phản ứng oxi hóa khử (Hóa 10 Cánh diều Bài 13)
I. Số oxi hóa
1. Khái niệm số oxi hóa
Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Ví dụ:
- Trong hợp chất ion:
K+Cl-: Số oxi hóa của K là +1, của Cl là –1.
Mg2+O2-: Số oxi hóa của Mg là +2, của O là –2.
- Trong hợp chất cộng hóa trị:
H–S–H: Với giả định là hợp chất ion, hai cặp electron chung sẽ lệch hoàn toàn về phía nguyên tử S (có độ âm điện cao hơn), mỗi liên kết đơn có 1 electron của H bị chuyển sang S nên hợp chất ion giả định là H+S2-H+.
Vậy số oxi hóa của H là +1, của S là –2.
2. Cách xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
Có hai cách để xác định số oxi hóa của các nguyên tử nguyên tố hóa học trong hợp chất:
Cách 1: Dựa theo số oxi hóa của một số nguyên tử đã biết và điện tích của phân tử hoặc ion. Theo cách này, có hai quy tắc:
Quy tắc 1:
- Số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0.
- Trong các hợp chất: Số oxi hóa của H là +1 (trừ một số hydride: NaH, CaH2, …); Số oxi hóa của O là –2 (trừ một số trường hợp như: OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, …) luôn là +1, của kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, …) luôn là +2; Số oxi hóa của Al luôn là +3.
Quy tắc 2: Tổng số oxi hóa của các nguyên tử trong phân tử bằng 0, trong một ion đa nguyên tử bằng chính điện tích của ion đó.
Ví dụ 1: Xác định số oxi hóa của S trong H2SO4.
Hướng dẫn:
Gọi số oxi hóa của S trong H2SO4 là x.
Trong hợp chất, số oxi hóa của H là +1, của O là –2.
Tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
2×(+1) + x + 4×(–2) = 0 x = +6.
Vậy S có số oxi hóa +6 trong H2SO4.
Ví dụ 2: Xác định số oxi hóa C trong K2CO3.
Hướng dẫn:
Gọi số oxi hóa của C trong K2CO3 là x.
Trong hợp chất, số oxi hóa của K là +1, của O là –2.
Ta có: 2×(+1) + x + 3×(-2) = 0 x = +4.
Vậy số oxi hóa của C trong K2CO3 là +4.
Ví dụ 3: Xác định số oxi hóa của N trong ion .
Hướng dẫn:
Gọi số oxi hóa của N trong ion là x.
Tổng các số oxi hóa của các nguyên tử trong một ion đa nguyên tử bằng chính điện tích của ion đó.
x + 3×(-2) = -1 x = +5.
Vậy số oxi hóa của N trong ion là +5.
Cách 2: Dựa theo công thức cấu tạo.
Đây là cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Cách này có ưu điểm là áp dụng được cho mọi trường hợp, tuy nhiên, cần phải biết công thức cấu tạo của chất.
Ví dụ 4: Xác định số oxi hóa của C và O trong CO2.
Hướng dẫn:
CO2 có công thức cấu tạo là O=C=O.
Trong mỗi liên kết đôi C=O, góp 2 electron, khi giả định CO2 là hợp chất ion thì 2 electron này chuyển sang O. Vì có hai liên kết C=O nên CO2 có công thức ion giả định là O2-C4+O2-. Từ đó xác định được số oxi hóa của O là –2, của C là +4.
Ví dụ 5: Xác định số oxi hóa của O và F trong OF2.
Hướng dẫn:
OF2 có công thức cấu tạo là F–O–F, công thức ion giả định của OF2 là F-O2+F-. Từ đó xác định được số oxi hóa của O là +2, F là –1.
II. Phản ứng oxi hóa – khử
1. Một số khái niệm
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của ít nhất một nguyên tố hóa học.
Ví dụ 1: Cho một số phản ứng sau:
(2) CuO + 2HCl CuCl2 + H2O
Trong các phản ứng trên:
Phản ứng (1) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Na và Cl.
Phản ứng (2) không phải là phản ứng oxi hóa – khử vì không có nguyên tố nào thay đổi số oxi hóa.
Phản ứng (3) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Cl.
Đối với phản ứng oxi hóa – khử, một số khái niệm sau thường được sử dụng:
- Chất khử (chất bị oxi hóa) là chất nhường electron. Ví dụ Na trong phản ứng (1) là chất khử.
- Chất oxi hóa (chất bị khử) là chất nhận eletron. Ví dụ Cl2 trong phản ứng (1) là chất oxi hóa.
- Quá trình oxi hóa (sự oxi hóa) là quá trình nhường electron. Ví dụ quá trình Na nhường electron trong phản ứng (1).
- Quá trình khử (sự khử) là quá trình nhận electron. Ví dụ quá trình Cl2 nhận electron trong phản ứng (1).
Chú ý: Trong phản ứng (3) ở ví dụ 1, Cl2 vừa là chất oxi hóa, vừa là chất khử.
2. Cân bằng phản ứng oxi hóa – khử theo phương pháp thăng bằng electron.
Ta có thể cân bằng phản ứng oxi hóa – khử theo nguyên tắc: Trong một phản ứng, tổng số electron nhường bằng tổng số electron nhận.
Ví dụ 1: Cân bằng phản ứng: Al + O2 Al2O3.
Bước 1: Xác định sự thay đổi số oxi hóa trước và sau phản ứng của các nguyên tử.
Bước 2: Viết các quá trình oxi hóa và quá trình khử.
Quá trình oxi hóa:
Quá trình khử:
Bước 3: Thăng bằng electron bằng cách nhân thêm hệ số vào các quá trình nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận.
Cộng các quá trình (đã nhân hệ số) với nhau thu được sơ đồ: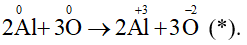
Bước 4: Dựa vào sơ đồ (*) để hoàn thành phương trình dạng phân tử.
4Al + 3O2 2Al2O3
Ví dụ 2: Cân bằng phương trình hóa học sau theo phương pháp thăng bằng electron:
Hướng dẫn:
Xác định các nguyên tố thay đổi số oxi hóa:
Quá trình nhường – nhận e:
Phương trình hóa học:
3. Ý nghĩa và một số phản ứng oxi hóa – khử quan trọng
Phản ứng oxi hóa – khử có ý nghĩa rất quan trọng, hầu hết các quá trình tự nhiên và nhân tạo trên Trái Đất đều có liên quan đến phản ứng oxi hóa – khử.
Một số oxi hóa – khử quan trọng:
a) Phản ứng liên quan đến việc cung cấp năng lượng:
- Phản ứng sinh ra năng lượng dưới dạng nhiệt khi đốt than là:
C + O2 CO2.
Phản ứng này là tỏa năng lượng.
- Các hoạt động của cơ thể đều cần năng lượng, sự hô hấp đã cung cấp oxygen để oxi hóa các chất, chẳng hạn đường glucose, sinh ra năng lượng:
C6H12O6 + 6O2 6CO2 + 6H2O.
Phản ứng này tỏa năng lượng.
b) Phản ứng liên quan đến việc lưu trữ năng lượng:
- Pin lithium – ion trong điện thoại, máy tính cũng như acquy trong ô tô, xe máy có thể dự trữ năng lượng dưới dạng điện năng dựa vào các phản ứng oxi hóa – khử.
- Phản ứng quang hợp cũng là một trong những phản ứng oxi hóa – khử quan trọng nhất trên Trái Đất, năng lượng được lấy từ ánh sáng mặt trời và tích trữ trong tinh bột.
6CO2 + 6H2O C6H12O6 + 6O2
- Lưu ý:
+ Bên cạnh những phản ứng oxi hóa – khử quan trọng, có ích lợi đối với con người, còn có một loại phản ứng oxi hóa - khử diễn ra ngoài ý muốn, chẳng hạn như các phản ứng ăn mòn kim loại, như sự tạo gỉ.
+ Hằng năm, lượng kim loại mất đi do sự tạo gỉ vào khoảng 10 - 30% lượng kim loại sản xuất ra, gây tổn thất lớn về kinh tế.
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Cánh diều hay khác:
- Lý thuyết Hóa 10 Bài 14: Phản ứng hóa học và enthalpy
- Lý thuyết Hóa 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học
- Lý thuyết Hóa 10 Bài 16: Tốc độ phản ứng hóa học
- Lý thuyết Hóa 10 Bài 17: Nguyên tố và đơn chất halogen
- Lý thuyết Hóa 10 Bài 18: Hydrogen halide và hydrohalic acid
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều

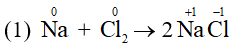
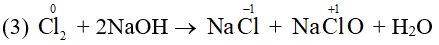
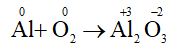
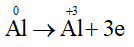
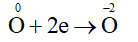
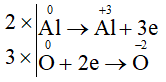
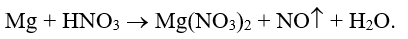
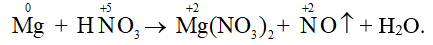
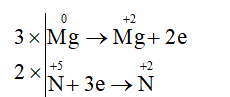
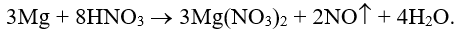



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

