Lý thuyết Mô hình nguyên tử và orbital nguyên tử (Hóa 10 Cánh diều Bài 4)
Với tóm tắt lý thuyết Hóa học 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử sách Cánh diều hay nhất, chi tiết sẽ giúp học sinh lớp 10 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Mô hình nguyên tử và orbital nguyên tử (Hóa 10 Cánh diều Bài 4)
I. Mô hình nguyên tử
1. Mô hình Rutherford – Bohr
Mô hình nguyên tử theo Rutherford – Bohr có các nội dung chính sau:
- Khối lượng nguyên tử tập trung chủ yếu ở hạt nhân.
- Electron quay xung quanh hạt nhân theo những quỹ đạo giống như các hành tinh quay xung quanh Mặt Trời.
- Năng lượng của electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân nguyên tử. Electron ở càng xa hạt nhân thì có năng lượng càng cao.
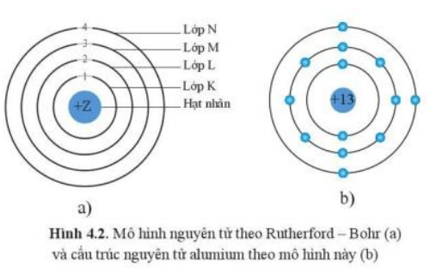
Ví dụ: Mô hình nguyên tử theo Rutherford – Bohr và cấu trúc nguyên tử alumium theo mô hình này.
Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron. Kí hiệu của mỗi lớp như sau:
- Lớp thứ nhất gọi là lớp K.
- Lớp thứ hai gọi là lớp L.
- Lớp thứ ba gọi là lớp M.
- Lớp thứ 4 gọi là lớp N.
Các electron được phân bố vào các lớp gần hạt nhân trước. Số electron tối đa trong mỗi lớp là 2n2, với n là số thứ tự lớp electron (n ≤ 4).
Ví dụ: Lớp M (n = 3) có số electron tối đa là 2n2 = 2×32 = 18.
Chú ý:
- Theo mô hình Rutherford – Bohr, các electron dù mang điện tích âm nhưng không thể bị hút vào hạt nhân bởi lực hút này cân bằng với lực quán tính li tâm tác dụng lên electron (kéo electron ra xa hạt nhân).
- Mô hình nguyên tử của Rutherford – Bohr đã giải thích được nhiều vấn đề trong khoa học nói chung và hóa học nói riêng, tuy nhiên nó vẫn còn một số hạn chế nhất định.
2. Mô hình hiện đại về nguyên tử
- Sự khác biệt cơ bản của mô hình hiện đại với mô hình nguyên tử của Rutherford – Bohr là các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo cố định.
- Theo mô hình hiện đại về nguyên tử, các electron chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân với xác suất tìm thấy khác nhau, sự chuyển động này tạo nên một hình ảnh giống như một đám mây electron.
II. Orbital nguyên tử
1. Khái niệm
- Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron ở khu vực đó là lớn nhất (khoảng 90%).
Ví dụ: Khu vực không gian trong khối cầu xung quanh hạt nhân helium mà xác suất tìm thấy electron tại đó là khoảng 90% chính là orbital nguyên tử của helium.
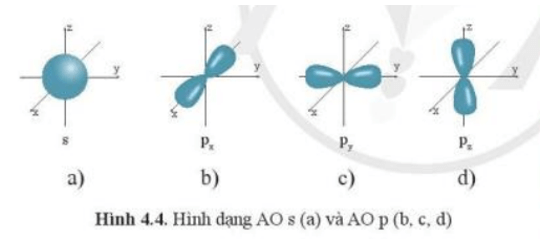
- Orbital nguyên tử có một số hình dạng khác nhau. Ví dụ: AO hình cầu, còn gọi là AO s; AO hình số tám nổi, còn gọi là AO p (tùy theo vị trí của AO p trên hệ trục tọa độ Descartes (Đề-các), sẽ gọi là AO px, py và pz).
2. Số lượng electron trong một AO
Một AO chỉ chứa tối đa 2 electron, 2 electron này được gọi là cặp electron ghép đôi. Nếu AO chỉ có 1 electron, electron đó được gọi là electron độc thân. Nếu AO không chứa electron nào thì gọi là AO trống.
Chú ý: Electron chuyển động trong AO s gọi là electron s, electron chuyển động trong AO p gọi là electron p, …
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 Cánh diều hay khác:
- Lý thuyết Hóa 10 Bài 5: Lớp, phân lớp và cấu hình electron
- Lý thuyết Hóa 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
- Lý thuyết Hóa 10 Bài 7: Xu hướng biến đổi một số tính chất của đơn chất, biến đổi thành phần và tính chất của hợp chất trong một chu kì và trong một nhóm
- Lý thuyết Hóa 10 Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
- Lý thuyết Hóa 10 Bài 9: Quy tắc octet
Xem thêm các tài liệu học tốt lớp 10 hay khác:
- Giải sgk Hóa học 10 Cánh diều
- Giải Chuyên đề Hóa học 10 Cánh diều
- Giải SBT Hóa học 10 Cánh diều
- Giải lớp 10 Cánh diều (các môn học)
- Giải lớp 10 Kết nối tri thức (các môn học)
- Giải lớp 10 Chân trời sáng tạo (các môn học)
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

