Tính chất của Brom (Br): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Bài viết Tính chất của Brom (Br): Tính chất hóa học, vật lí, Điều chế, Ứng dụng với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Tính chất của Brom (Br): Tính chất hóa học, vật lí, Điều chế, Ứng dụng.
Tính chất của Brom (Br): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
I. Trạng thái tự nhiên
- Tồn tại ở dạng hợp chất, chủ yếu là muối bromua của kali, natri, magie.
- Bromua kim loại có trong nước biển, nước của 1 số hồ cùng với muối clorua.
II. Tính chất của brom
1. Tính chất vật lý
- Brom là chất lỏng màu đỏ nâu, mùi khó chịu, dễ bay hơi, độc.
- Brom Là chất ôxi hóa yếu hơn clo.
2. Tính chất hóa học
a. Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
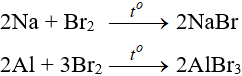
b. Tác dụng với hidro
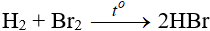
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
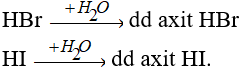
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
c. Tính khử của Br2, HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H2O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
III. Ứng dụng, điều chế
1. Ứng dụng
- Brom dùng để chế tạo 1 số dược phẩm, phẩm nhuộm, …
- Dùng chế tạo AgBr chất dùng để tráng lên phim ảnh.
2. Điều chế
- Nguồn chính để điều chế brom là nước biển.
- Điều chế brom dựa trên sự oxi hóa ion Br-, chất oxi hóa là clo.
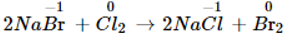
IV. Một số hợp chất của brom
1. Hidro bromua và hydrobromic acid
- Ở nhiệt độ thường, HBr là chất khí, không màu, "bốc khói" trong không khí ẩm và rất dễ tan trong nước.
- Dung dịch HBr trong nước được gọi là dung dịch axitbromhiđric. Axitbromhiđric là một axit mạnh, mạnh hơn hydrochloric acid.
- Tính khử:
HBr có tính khử mạnh hơn HCl, HBr khử được H2SO4 đặc thành SO2.
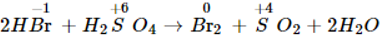
Dung dịch HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dung dịch HF và HCl không có phản ứng này):
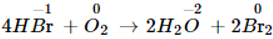
2. Hợp chất chứa oxi của brom
- Axit hipobromo (HBrO) có tính bền, tính oxi hóa và tính axit kém HClO.
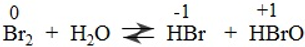
- Axit bromic (HBrO3).
- Axit pebromic (HBrO4).
Tương tự như clo, trong các hợp chất với oxi brom thể hiện số oxi hóa dương (+1, +3, +5, +7).
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi Tốt nghiệp THPT khác:
Lý thuyết Hidro clorua - hydrochloric acid (HCl) và muối clorua
- Lý thuyết về clo và hợp chất của clo
- Tóm tắt lý thuyết Hóa 10 chương 5
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

