Tính chất của Flo (F): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Bài viết Tính chất của Flo (F): Tính chất hóa học, vật lí, Điều chế, Ứng dụng với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Tính chất của Flo (F): Tính chất hóa học, vật lí, Điều chế, Ứng dụng.
Tính chất của Flo (F): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
I. Trạng thái tự nhiên
- Trong tự nhiên, Flo chỉ tồn tại ở dạng hợp chất.
- Hợp chất của Flo có trong men răng của người và động vật, trong lá của 1 số loài cây.
- Phần lớn Flo tập trung trong 2 khoáng vật là Florit (CaF2) và criolit (Na3AlF6).
II. Tính chất vật lý
- Flo là chất khí, màu lục nhạt, độc.
- Flo Là phi kim mạnh nhất (có độ âm điện lớn nhất) ⇒ Flo có tính oxi hóa mạnh nhất.
- Tham gia phản ứng với hầu hết các đơn chất và hợp chất tạo florua với số oxy hoá -1(kể cả vàng).
- Với khí H2: phản ứng nổ mạnh, xảy ra ngay cả trong bóng tối, nhiệt độ thấp.
Ví dụ: H2 + F2 → 2HF (khí hidro florua)
- Khí HF tan vô hạn trong nước tạo ra dd axit flohidric, khác với axit HCl, axit HF là axit yếu, tính chất đặc biệt của axit HF là tác dụng với silic đioxit (SiO2) có trong thành phần thủy tinh.
→ Do đó không dùng chai lọ thủy tinh để đựng dd axit HF.
SiO2 + 4HF → SiF4 (Silic tetrafloru) + 2H2O
- Hơi nước bốc cháy khi tiếp xúc với khí flo: 2F2 + 2H2O → 4HF + O2
III. Tính chất hóa học
1. Tác dụng với kim loại và phi kim
Ca + F2 → CaF2
2Ag + F2 → 2AgF
3F2 + 2Au → 2AuCl3
3F2 + S → SF6
2. Tác dụng với hidro:
- Phản ứng xảy ra mạnh hơn các halogen khác, hỗn hợp H2, F2 nổ mạnh trong bóng tối.
H2 + F2 → 2HF
- Khí HF tan vào nước tạo dung dịch HF. Dung dịch HF là axit yếu, đặc biệt là hòa tan được SiO2.
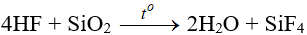
(sự ăn mòn thủy tinh được ứng dụng trong kĩ thuật khắc trên kính như vẽ tranh khắc chữ)
3. Tác dụng với nước
Khí flo qua nước sẽ làm bốc cháy nước (do giải phóng O2).
2F2 + 2H2O → 4HF + O2
Phản ứng này giải thích vì sao F2 không đẩy Cl2, Br2, I2 ra khỏi dung dịch muối hoặc axit trong khi flo có tính oxi hóa mạnh hơn.
IV. Ứng dụng, điều chế
1. Ứng dụng
- Dùng làm chất oxi hóa cho nhiên liệu lỏng dùng trong tên lửa.
- Điều chế 1 số dẫn xuất có những tính chất độc đáo.
- Dung dịch NaF loãng dùng làm thuốc chống sâu răng.
- Dùng trong công nghiệp sản xuất hạt nhân.
2. Điều chế
Vì flo có tính oxi hóa mạnh nhất nên phương pháp duy nhất để điều chế flo là dùng dòng điện để oxi hóa ion F- trong florua nóng chảy (phương pháp điện phân).
Trong công nghiệp, người ta điện phân hỗn hợp KF + 2HF (nhiệt độ nóng chảy 70oC).
V. Một số hợp chất của flo
1. Hiđro florua và axit flohiđric
- Vì phản ứng của flo với hiđro quá mãnh liệt nên phương pháp duy nhất để điều chế hiđro florua là cho canxi florua tác dụng với axit sunfuric đặc ở 250oC:
CaF2 + H2SO4 → CaSO4 + 2HF
- Hiđro clorua tan vô hạn trong nước tạo ra dung dịch axit flohiđric. Khác với hydrochloric acid, axit flohiđric là axit yếu.
- Tính chất đặc biệt của axit flohiđric là tác dụng với silic đioxit (có trong thành phần của thủy tinh).
SiO2 + 4HF → SiF4 (Silic tetraflorua) + 2H2O
2. Hợp chất với oxi: OF2 là chất khí không màu, có mùi đặc biệt, rất độc, có tính oxi hóa mạnh.
2F2 + 2NaOH → 2NaF + H2O + OF2
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi Tốt nghiệp THPT khác:
Lý thuyết Hidro clorua - hydrochloric acid (HCl) và muối clorua
- Lý thuyết về clo và hợp chất của clo
- Tóm tắt lý thuyết Hóa 10 chương 5
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

