Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Bài viết Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng.
Tính chất của Axit HCl (hydrochloric acid): Tính chất hóa học, vật lí, Điều chế, Ứng dụng chi tiết nhất
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Bài giảng: Bài 23: Hiđro clorua - hydrochloric acid và muối clorua - Cô Phạm Huyền (Giáo viên VietJack)
I. Hidro clorua
- Hiđro clorua (HCl) là chất khí, không màu, mùi xốc tan nhiều trong nước tạo thành dung dịch axit mạnh HCl; Nặng hơn không khí.
II. Hydrochloric acid (HCl)
1/ Tính chất vật lí
- Hiđro clorua (HCl) tan vào nước tạo thành dung dịch hydrochloric acid (HCl).
- Axit HCl là chất lỏng không màu, dễ bay hơi. Dung dịch axit HCl không màu, HCl đặc bốc khói trong không khí ẩm.
2/ Tính chất hóa học
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
a/ Tác dụng chất chỉ thị:
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
b/ Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
c/ Tác dụng với basic oxide và bazo:
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
d/ Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
3/ Điều chế
a/ Phương pháp sunfat: cho NaCl tinh thể vào dung dịch H2SO4 đậm đặc
2NaCltt + H2SO4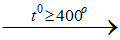
NaCltt + H2SO4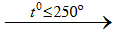
b/ Phương pháp tổng hợp: đốt hỗn hợp khí hidro và khí clo
H2 + Cl2
III. Muối clorua và nhận biết ion clorua
- Muối của hydrochloric acid được gọi là muối clorua. Chứa ion âm clorua (Cl-) và các ion dương kim loại, NH4+như NaCl, ZnCl2 CuCl2,AlCl3
- Công thức tổng quát: MCln.
- Các muối clorua hầu hết đều tan trừ PbCl2 và AgCl, CuCl, Hg2 Cl2.
- Để nhận biết ion Cl-có thể dùng thuốc thử là dung dịch AgNO3 do tạo thành AgCl kết tủa trắng (AgCl tan trong dung dịch amonia do tạo phức với NH3):
AgNO3 + NaCl → AgCl + NaNO3
* Ứng dụng:
- NaCl dùng để ăn, sản xuất Cl2, NaOH, axit HCl
- KCl phân kali
- ZnCl2 tẩy gỉ khi hàn, chống mục gỗ.
- BaCl2 chất độc
- CaCl2 chất chống ẩm
- AlCl3 chất xúc tác
Thi online Hóa 10 KNTTThi online Hóa 10 CDThi online Hóa 10 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi Tốt nghiệp THPT khác:
Để học tốt lớp 10 các môn học sách mới:
- Giải bài tập Lớp 10 Kết nối tri thức
- Giải bài tập Lớp 10 Chân trời sáng tạo
- Giải bài tập Lớp 10 Cánh diều
Tủ sách VIETJACK shopee lớp 10-11 (cả 3 bộ sách):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 10 Global Success
- Giải Tiếng Anh 10 Friends Global
- Giải sgk Tiếng Anh 10 iLearn Smart World
- Giải sgk Tiếng Anh 10 Explore New Worlds
- Lớp 10 - Kết nối tri thức
- Soạn văn 10 (hay nhất) - KNTT
- Soạn văn 10 (ngắn nhất) - KNTT
- Soạn văn 10 (siêu ngắn) - KNTT
- Giải sgk Toán 10 - KNTT
- Giải sgk Vật lí 10 - KNTT
- Giải sgk Hóa học 10 - KNTT
- Giải sgk Sinh học 10 - KNTT
- Giải sgk Địa lí 10 - KNTT
- Giải sgk Lịch sử 10 - KNTT
- Giải sgk Kinh tế và Pháp luật 10 - KNTT
- Giải sgk Tin học 10 - KNTT
- Giải sgk Công nghệ 10 - KNTT
- Giải sgk Hoạt động trải nghiệm 10 - KNTT
- Giải sgk Giáo dục quốc phòng 10 - KNTT
- Lớp 10 - Chân trời sáng tạo
- Soạn văn 10 (hay nhất) - CTST
- Soạn văn 10 (ngắn nhất) - CTST
- Soạn văn 10 (siêu ngắn) - CTST
- Giải Toán 10 - CTST
- Giải sgk Vật lí 10 - CTST
- Giải sgk Hóa học 10 - CTST
- Giải sgk Sinh học 10 - CTST
- Giải sgk Địa lí 10 - CTST
- Giải sgk Lịch sử 10 - CTST
- Giải sgk Kinh tế và Pháp luật 10 - CTST
- Giải sgk Hoạt động trải nghiệm 10 - CTST
- Lớp 10 - Cánh diều
- Soạn văn 10 (hay nhất) - Cánh diều
- Soạn văn 10 (ngắn nhất) - Cánh diều
- Soạn văn 10 (siêu ngắn) - Cánh diều
- Giải sgk Toán 10 - Cánh diều
- Giải sgk Vật lí 10 - Cánh diều
- Giải sgk Hóa học 10 - Cánh diều
- Giải sgk Sinh học 10 - Cánh diều
- Giải sgk Địa lí 10 - Cánh diều
- Giải sgk Lịch sử 10 - Cánh diều
- Giải sgk Kinh tế và Pháp luật 10 - Cánh diều
- Giải sgk Tin học 10 - Cánh diều
- Giải sgk Công nghệ 10 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 10 - Cánh diều
- Giải sgk Giáo dục quốc phòng 10 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

