30 Bài tập về Hợp chất của nhôm cực hay, có lời giải chi tiết
Với 30 Bài tập về Hợp chất của nhôm có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm Bài tập về Hợp chất của nhôm
30 Bài tập về Hợp chất của nhôm cực hay, có lời giải chi tiết
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập trọng tâm về kim loại kiềm, kim loại kiềm thổ và nhôm - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Bài 1: Trộn dung dịch chứa a mol AlCl3 với dung dịch chứa b mol NaOH. Để thu được kết tủa thì cần có tỉ lệ
A. a : b = 1 : 4. B. a : b < 1 : 4.
C. a : b = 1 : 5. D. a : b > 1 : 4.
Lời giải:
Đáp án: D
AlCl3 (a) + 3NaOH (3a) → Al(OH)3↓ (a mol) + 3NaCl
Al(OH)3 (a) + NaOH (a mol) → NaAlO2 + 2H2O
Nếu số mol NaOH ≥ 4a thì kết tủa tan hết.
Do đó để có kết tủa thì nNaOH < 4a hay b < 4a → a : b > 1 : 4.
Bài 2: Cho 200 ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là
A. 1,2. B. 1,8.
C. 2,4. D. 2.
Lời giải:
Đáp án: D
nAlCl3 = 0,2.1,5 = 0,3 (mol) > nAl(OH)3 = 15,6 : 78 = 0,2 (mol)
Để V có giá trị lớn nhất → xảy ra trường hợp tạo kết tủa cực đại, sau đó kết tủa tan 1 phần còn lại đúng 0,2 mol
→ nAl(OH)3 = 4nAl3+ - nOH-
→ 0,2 = 4. 0,3 – nOH-
→ nOH- = 1 (mol)
→ VNaOH = nNaOH : CM = 1 : 0,5 = 2 (lít).
Bài 3: Al2O3 phản ứng được với cả hai dung dịch nào sau đây?
A. Na2SO4, KOH. B. NaOH, HCl.
C. KCl, NaNO3. D. NaCl, H2SO4.
Lời giải:
Đáp án: B
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O.
Bài 4: Cho các hợp chất hay quặng sau: criolit, đất sét, mica, boxit, phèn chua. Có bao nhiêu trường hợp chứa hợp chất của nhôm?
A. 5. B. 2.
C. 3. D. 4.
Lời giải:
Đáp án: A
Criolit: Na3AlF6; đất sét chứa khoáng Al2O3.2SiO2.2H2O; mica: thành phần có chứa nhôm; boxit chứa Al2O3; phèn chua K2SO4. Al2(SO4)3.24H2O.
Bài 5: Cho các chất sau: Al, Al2O3, AlCl3, Al(OH)3. Số chất thể hiện tính chất lưỡng tính là
A. 4. B. 3.
C. 2. D. 1.
Lời giải:
Đáp án: C
Al2O3 và Al(OH)3 có tính lưỡng tính.
Bài 6: Chất nào sau đây không thể vừa phản ứng với dung dịch NaOH và vừa phản ứng với dung dịch HCl?
A. Al2(SO4)3. B. Al2O3.
C. Al(OH)3. D. NaHCO3.
Lời giải:
Đáp án: A
Al2(SO4)3 không phản ứng với HCl.
Bài 7: Cho sơ đồ phản ứng: Al2(SO4)3 → X → Y → Al.
Trong sơ đồ trên, mỗi mũi tên là một phản ứng, các chất X, Y lần lượt là những chất nào sau đây?
A. Al2O3 và Al(OH)3. B. Al(OH)3 và Al2O3.
C. Al(OH)3 và NaAlO2. D. NaAlO2 và Al(OH)3.
Lời giải:
Đáp án: B
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
2Al(OH)3 -to→ Al2O3 + 3H2O
2Al2O3 -dpnc→ 4Al + 3O2
Bài 8: Thực hiện các thí nghiệm sau:
(a) Cho từ từ khí CO2 đến dư vào dung dịch Ca(OH)2.
(b) Cho từ từ dung dịch NaOH đến dư vào dung dịch AlCl3.
(c) Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3.
(d) Cho từ từ dung dịch HCl đến dư vào dung dịch NaAlO2.
(e) Cho từ từ khí CO2 đến dư vào dung dịch NaAlO2.
Số thí nghiệm có kết tủa trắng sau khi phản ứng kết thúc là
A. 3. B. 2.
C. 4. D. 1.
Lời giải:
Đáp án: B
Hai trường hợp thu được kết tủa sau phản ứng là
(c) Cho từ từ dung dịch NH3 đến dư vào dung dịch AlCl3.
(e) Cho từ từ khí CO2 đến dư vào dung dịch NaAlO2.
Bài 9: Cho 100ml dung dịch AlCl3 1M tác dụng với 200ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi được chất rắn cân nặng 2,55 gam. Nồng độ của dung dịch NaOH ban đầu là
A. 1,25M. B. 1,50M.
C. 1,75M. D. 1,00M.
Lời giải:
Đáp án:
Số mol AlCl3 là: 0,1.1 = 0,1 mol; số mol Al2O3 là 2,55 : 102 = 0,025 mol.
AlCl3 (0,1) + 3NaOH (0,3) → Al(OH)3 ↓ (0,1 mol) + 3NaCl
Al(OH)3 ↓ + NaOH → NaAlO2 + 2H2O
(0,1 – 0,05) → 0,05 mol
2Al(OH)3 (0,05) → Al2O3 (0,025 mol) + 3H2O
∑nNaOH = 0,3 + 0,05 = 0,35 mol → VNaOH = 0,35 : 0,2 = 1,75M.
Bài 10: Cho các chất rắn đựng trong các lọ mất nhãn BaO, MgO, Al2O3. Chỉ dùng một hóa chất nào sau đây có thể nhận biết được 3 chất trên?
A. H2O. B. HCl.
C. H2SO4. D. Fe(OH)2.
Lời giải:
Đáp án: A
- Hòa tan lần lượt các mẫu vào nước, mẫu chất rắn nào tan là BaO
PTHH: BaO + H2O → Ba(OH)2
- Lấy Ba(OH)2 cho vào 2 chất rắn còn lại, chất nào tan ra là Al2O3 còn lại là MgO
PTHH: Ba(OH)2 + Al2O3 + H2O → Ba(AlO2)2 + 2H2O .
Bài 11: Cho V lít dung dịch NaOH 0,4M tác dụng với dung dịch Al2(SO4)3 có chứa 58,14g chất tan thu được 23,4g kết tủa. Giá trị lớn nhất của V là
A. 2,65l. B. 2,24l .
C. 1,12l. D. 3,2 l.
Lời giải:
Đáp án: A
Số mol Al3+ = 0,34 mol.
Số mol Al(OH)3 = 0,3 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3. 0,3 = 0,9 mol.
→ V(dd NaOH) = 2,25 lít = Vmin
+TH2: Al3+ hết → tạo
Al(OH)3: 0,3 mol và [Al(OH)4]-: 0,34 – 0,3 = 0,04 mol
→ Số mol OH- = 3 . 0,3 + 4 . 0,04 = 1,06 mol
→ V(dd NaOH) = 2,65 lít = Vmax.
Bài 12: Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100cm3 dung dịch Al2(SO4)3 1M. Nồng độ mol của NaOH trong dung dịch sau phản ứng là
A. 0,8M. B. 1,2M.
C. 1M. D. 0,75M.
Lời giải:
Đáp án: C
Ta có: nNaOH = 7.0,15 = 1,05 mol; nAl2(SO4)3 = 1.0,1 = 0,1 mol
Al2(SO4)3 (0,1) + 6NaOH (0,6) → 2Al(OH)3↓ (0,3 mol) + 3Na2SO4
Vì NaOH dư nên:
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau phản ứng có 0,2 mol Na[Al(OH)4] và 0,25 mol NaOH dư.
Nồng độ mol của
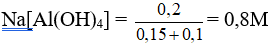
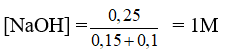
Bài 13: Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là
A. 0,2. B. 0,15.
C. 0,1. D. 0,05.
Lời giải:
Đáp án: C
Ta có: nOH- = nNaOH = 0,7 mol
nAl3+ = 2.0,1 = 0,2 mol
Al3+ (0,2) + 3OH- (0,6) → Al(OH)3↓ (0,2 mol)
⇒ nOH- dư = 0,7 - 0,6 = 0,1 mol
Al(OH)3 (0,1) + OH- (0,1) → AlO2- + 2H2O
⇒ nAl(OH)3 = 0,2 - 0,1 = 0,1 mol
Bài 14: Trộn 100 ml dung dịch Al2(SO4)3 0,2M với 100 ml dung dịch HCl xM thu được dung dịch Y. Cho 10,96 gam Ba vào dung dịch Y, thu được 14,76 gam kết tủa. Giá trị của x là
A. 0,30. B. 0,15.
C. 0,10. D. 0,70.
Lời giải:
Đáp án: C
Dung dịch Y gồm Al3+ 0,04 mol; SO42- 0,06 mol; H+ 0,1x mol; Cl- 0,1x mol
Theo bài ra nBa = 0,08 mol
Giả sử cho Ba vào Y chỉ thu được kết tủa là BaSO4 → n↓ = 0,063 > nSO42- = 0,06. Vậy kết tủa là BaSO4 0,06 mol và Al(OH)3
Khối lượng Al(OH)3 = 14,76 – 0,06. 233 = 0,78 → Số mol Al(OH)3 = 0,01 mol
Sau khi cho Ba vào dung dịch Y, dung dịch sau phản ứng chứa các ion:
Ba2+: 0,08 – 0,06 = 0,02 mol;
Cl-: 0,1x mol;
AlO2-: 0,04 – 0,01 = 0,03 mol
Áp dụng định luật bảo toàn điện tích có: 0,02.2 = 0,1.x + 0,03 → x = 0,1.
Bài 15: Nhỏ vài giọt dung dịch natri carbonate vào dung dịch nhôm clorua. Hiện tượng thu được là:
A. Xuất hiện kết tủa trắng.
B. Sủi bọt khí.
C. Không hiện tượng.
D. Xuất hiện kết tủa trắng và sủi bọt khí.
Lời giải:
Đáp án: D
3Na2CO3 + 2AlCl3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
Bài 16: Hoàn tan hoàn toàn hỗn hợp gồm K2O, Al2O3; và MgO vào nước dư sau phản ứng hoàn toàn thu được dung dịch X và chất rắn Y. Sục khí CO2 tới dư vào dung dịch X sau phản ứng thu được kết tủa là
A. BaCO3. B. Al(OH)3.
C. MgCO3. D. Mg(OH)2.
Lời giải:
Đáp án: B
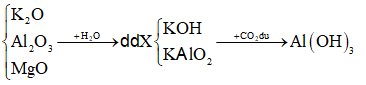
Bài 17: Chia m gam hỗn hợp Na2O và Al2O3 thành 2 phần bằng nhau:
- Phần 1: Hoà tan trong nước dư thu được 1,02 gam chất rắn không tan.
- Phần 2: Hoà tan vừa hết trong 140 ml dung dịch HCl 1M. Giá trị của m là
A. 2,26. B. 2,66.
C. 5,32. D. 7,00.
Lời giải:
Đáp án: C
Gọi số mol của Na2O và Al2O3 trong từng phần là x và y
* Phần 1:
Ta có các phương trình phản ứng:
Na2O (x) + H2O → 2NaOH (2x mol)
2NaOH (2x) + Al2O3 (x mol) → 2NaAlO2 + H2O
Chất rắn không tan là Al2O3
* Phần 2:
nHCl = 0,14.1 = 0,14 mol
Ta có phương trình phản ứng:
Na2O + 2HCl → 2NaCl + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
nHCl = 2x + 6y = 0,14 (2)
Từ (1) và (2) ta có: x = 0,01, y = 0,02
→ m = mNa2O + mAl2O3
Bài 18: Dẫn từ từ 15,68 lít khí NH3 (đktc) vào 200 ml dung dịch AlCl3 1M thu được m gam kết tủa. Giá trị của m là
A. 18,2. B. 15,6.
C. 54,6. D. 7,8.
Lời giải:
Đáp án:
3NH3 + 3H2O + AlCl3 → Al(OH)3↓ + 3NH4Cl
nNH3 = 15,68:22,4 = 0,7 mol; nAlCl3 = 0,2.1 = 0,2 mol
Xét thấy
0,7:3 > 0,2:1 → AlCl3 hết → nAl(OH)3 = 0,2.78 = 15,6 gam
Bài 19: Loại đá quặng nào sau đây không phải là hợp chất của nhôm?
A. Đá rubi. B. Đá saphia.
C. Quặng boxit. D. Quặng đôlômit.
Lời giải:
Đáp án: D
Quặng đôlômit MgCO3.CaCO3.
Bài 20: Cho a mol NaAlO2 tác dụng với dung dịch chứa b mol HCl, để sau phản ứng thu được kết tủa thì


Lời giải:
Đáp án: A
Ta có phản ứng:
NaAlO2 (a) + HCl (a) + H2O → NaCl + Al(OH)3 (a mol)
Al(OH)3 (a) + 3HCl (3a mol) → AlCl3 + 3H2O
Để sau phản ứng vẫn thu được kết tủa thì ∑nHCl < 4a
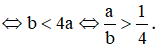
Bài 21: Cho các hợp chất: NaOH, Al(OH)3 , KOH, Mg(OH)2. Sắp xếp theo thứ tự tính bazơ giảm dần là
A. Mg(OH)2 ; Al(OH)3 ; KOH ; NaOH.
B. Al(OH)3 ; NaOH ; Mg(OH)2 ; KOH.
C. KOH ; NaOH ; Mg(OH)2 ; Al(OH)3.
D. Al(OH)3 ; Mg(OH)2 ; NaOH ; KOH.
Lời giải:
Đáp án: C
Bài 22: Phèn chua được dùng trong ngành công nghiệp thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. Công thức hoá học của phèn chua là
A. Na2SO4.Al2(SO4)3.24H2O.
B. K2SO4.Al2(SO4)3.24H2O.
C. (NH4)2SO4.Al2(SO4)3.24H2O.
D. Li2SO4.Al2(SO4)3.24H2O.
Lời giải:
Đáp án: B
Phèn chua: K2SO4.Al2(SO4)3.24H2O.
Bài 23: Sục khí NH3 đến dư vào dung dịch nào dưới đây để thu được kết tủa?
A. CuCl2. B. KNO3.
C. NaCl. D. AlCl3.
Lời giải:
Đáp án: D
Bài 24: Criolit dùng trong khi điện phân nóng chảy Al2O3 có công thức là
A. NaAlO2. B. K3AlF6.
C. Na3AlF6. D. AlF3.
Lời giải:
Đáp án: C
Bài 25: Hòa tan hoàn toàn 9,8 gam hỗn hợp X gồm Na và Al2O3 vào nước thu được 1,792 lít H2 (đktc) và dung dịch Y. Cho từ từ dung dịch HCl vào dung dịch Y thì thấy khối lượng kết tủa biến thiên theo đồ thị sau:
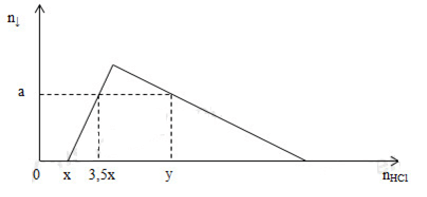
Giá trị của y là
A. 0,18. B. 0,20.
C. 0,22. D. 0,81.
Lời giải:
Đáp án: C
nH2 = 0,08 mol
Gọi số mol Na và Al2O3 lần lượt là x, y (mol)
2Na (0,16) + 2H2O → 2NaOH (0,16) + H2 (0,8 mol)
⇒ mAl2O3 = mX – mNa = 9,8 – 23.0,16 = 6,12 gam
⇒ nAl2O3 = 0,06 mol
Al2O3 + 2OH- → 2AlO2- + H2O
0,06 → 0,12 dư 0,04 → 0,12 (mol)
Vậy dung dịch X gồm: OH- dư (0,04 mol) và AlO2- (0,12 mol)
Quan sát đồ thị:
Tại nHCl = x mol: OH- dư vừa bị trung hòa hết ⇒ x = nOH- = 0,04 mol
Tại nHCl = 3,5x = 0,14 mol: nH+ = nOH- + nAl(OH)3 ⇒ 0,14 = 0,04 + nAl(OH)3
⇒ a = nAl(OH)3 = 0,1 mol
Tại nHCl = y mol: nHCl = nOH- + nAlO2- + 3(nAlO2- - nAl(OH)3) = nOH- + 4nAlO2- - 3nAl(OH)3
⇒ y = 0,04 + 4.0,12 – 3.0,1 = 0,22 mol
Bài 26: Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol Ba(OH)2 và b mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị bên.
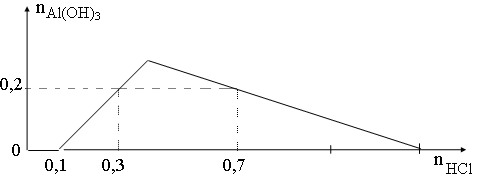
Tỉ lệ a: b là
A. 1: 3. B. 1: 2.
C. 2: 1. D. 2: 3.
Lời giải:
Đáp án: A
Từ đồ thị ta thấy số mol HCl bắt đầu 0,1 mol mới xuất hiện kết tủa
⇒ 0,1 mol HCl dùng để trung hòa Ba(OH)2
⇒ nOH- = nH+ = 0,1 (mol) ⇒ nBa(OH)2 = 1/2 nOH- = 0,05 (mol) = a
Ta thấy tại giá trị nHCl = 0,3 và 0,7 mol đều thu được lượng kết tủa như nhau Al(OH)3: 0,2 (mol)
⇒ Tại nHCl = 0,7 mol thì lượng kết tủa Al(OH)3 đã đạt cực đại, sau đó bị hòa tan đến khi còn 0, 2 mol
Áp dung công thức ta có:
nH+ = 4nAlO2 – 3nAl(OH)3 + nOH-
⇒ 0, 7 = 4. 2b – 3. 0,2 + 0,1
⇒ b = 0,15 (mol)
Vậy a: b = 0,05: 0,15 = 1: 3.
Bài 27: Có thể sử dụng dung dich nào sau đây để nhận biết ion Al3+ trong dung dịch?
A. NaCl. B. NaOH.
C. HCl. D. NaNO3.
Lời giải:
Đáp án: B
Cho từ từ dung dịch NaOH đến dư vào dung dịch thí nghiệm, nếu thấy kết tủa keo xuất hiện rồi tan trong NaOH dư thì chứng tỏ trong dung dịch có ion Al3+.
Bài 28:Chất nào sau đây có khả năng làm trong nước đục?
A. nước gia – ven. B. clorua vôi.
C. phèn chua. D. nước clo.
Lời giải:
Đáp án: C
Phèn chua được dùng đề làm trong nước.
Bài 29: Chất nào sau đây được dùng làm vật liệu mài?
A. tinh thể Al2O3. B. bột Al2O3.
C. phèn chua. D. Al(OH)3.
Lời giải:
Đáp án: B
Bột Al2O3 được dùng làm vật liệu mài.
Bài 30: Chất nào sau đây không bị khử bởi CO ở nhiệt độ cao?
A. CuO. B. FeO.
C. ZnO. D. Al2O3.
Lời giải:
Đáp án: D
CO chỉ khử được oxit của kim loại đứng sau nhôm trong dãy hoạt động hóa học.
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Bài tập về Kim loại kiềm thổ cực hay, có lời giải chi tiết
- Bài tập về Kim loại kiềm cực hay, có lời giải chi tiết
- Bài tập về Nhôm cực hay, có lời giải chi tiết
- Bài tập về Crom (Cr) cực hay, có lời giải chi tiết
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

