Cách giải Bài tập về tính khử của hợp chất crom 2 (II) (hay, chi tiết)
Bài viết Cách giải Bài tập về tính khử của hợp chất crom 2 (II) với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách giải Bài tập về tính khử của hợp chất crom 2 (II).
Cách giải Bài tập về tính khử của hợp chất crom 2 (II) (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập tổng hợp về sắt và hợp chất của sắt - Cô Nguyễn Thị Thu (Giáo viên VietJack)
I. Phương pháp
1. Oxit CrO
- CrO là một basic oxide, màu đen
- CrO có tính khử, trong không khí CrO dễ bị oxi hóa thành Cr2O3.
2. Hidroxit Cr(OH)2
- Cr(OH)2 là chất rắn, màu vàng.
- Cr(OH)2 có tính khử, trong không khí oxi hóa thành Cr(OH)3
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
- Cr(OH)2 là một bazơ.
3. Muối crom (II)
- Muối crom (II) có tính khử mạnh.
4CrCl2 + O2 + 4HCl → 4CrCl3 + 2H2O
- Dung dịch CrCl2 để ngòai không khí lại chuyển từ màu xanh lam sang màu lục
- CrCl2 trong dung dịch phân ly ra Cr2+ và Cl-. Ion Cr2+ tồn tại ở dạng
[ Cr(H2O) ]2+ có màu xanh, nên dung dịch CrCl2 có màu xanh.
- Mặt khác trạng thái oxi hóa +2 của Cr có tính khử mạnh, ngay trong dung dịch CrCl2 bị oxi hóa bởi oxi không khí chuyển thành CrCl3. Ion Cr3+ trong dung dịch tồn tại dưới dạng [Cr(H2O)]3+ có màu lục. Nên trong không khí CrCl2 chuyển từ màu xanh lam sang màu lục .
II. Ví dụ minh họa
Ví dụ 1: Hòa tan hết 1,56 gam bột crom vào 550 ml dung dịch HCl 0,2M đun nóng thu được dung dịch A. Sục O2 dư vào A thu được dung dịch B. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch B để thu được lượng kết tủa lớn nhất.
Lời giải:
Giải thích:
nCr = 1,56/52 = 0,03 mol; nHCl = 0,55. 0,2 = 0,11 mol
Cr + 2HCl → CrCl2 + H2
(mol): 0,03 0,06 0,03 0,03
4CrCl2 + O2 + 4HCl → 4CrCl3 + H2O
(mol): 0,03 0,03 0,03
Dung dịch A thu được gồm: CrCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol
Để thu được lượng kết tủa lớn nhất:
HCl + NaOH → NaCl + H2O
(mol): 0,02 0,02
CrCl3 + 3NaOH → Cr(OH)3 + 3NaCl
(mol): 0,03 0,09 0,03
Thể tích dung dịch NaOH cần dùng = (0,02+0,09)/0,5 = 0,22 (l)
Ví dụ 2: Có các phương trình hóa học sau:
1. CrO + 2HCl → CrCl2 + H2O.
2. CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl.
3. 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
4. Cr(OH)2 + 2HCl → CrCl2 + 2H2O
5. 4CrCl2 + 4HCl + O2 → 4CrCl3 + 2H2O
Số lượng phản ứng minh hoạ tính khử của hợp chất crom (II) là
A. 2 B. 3
C. 4 D. 5
Lời giải:
Chọn đáp án: A
Giải thích: Phản ứng thể hiện tính khử của crom (III) là: 3, 5
Ví dụ 3: Cho 2,46g CrCl2 tác dụng với dung dịch NaOH vừa đủ thu kết tủa (A). Nung (A) trong không khí đến khối lượng không đổi thu m gam chất rắn. Giá trị của m
A. 0,68
B. 0,78
C. 1,52
D. 1,2
Lời giải:
Chọn đáp án: C
Giải thích:
CrCl2 + 2NaOH → Cr(OH)2↓màu vàng + 2NaCl
2Cr(OH)2 + 1/2O2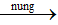
nCrCl2 = 0,02 mol => nCr2O3 = 1/2 . 0,02 = 0,01 mol
mCr2O3 = 152. 0,01 = 1,52g
Ví dụ 4: Cho dung dịch chứa 0,5 mol NaOH vào dung dịch chứa 0,2 mol CrCl2 rồi để trong không khí đến phản ứng hoàn toàn. Lượng kết tủa cuối cùng thu được là
A. 10,3g
B. 20,6g
C. 8,6g
D. 17,2g
Lời giải:
Chọn đáp án: A
Giải thích:
CrCl2 + 2NaOH → Cr(OH)2↓màu vàng + 2NaCl (1)
0,2 → 0,4 mol
4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3 (2)
0,2 mol → 0,2 mol
Cr(OH)3 + NaOH → NaCrO2 + 2H2O (3)
0,1 mol ← 0,1 mol
nNaOH (1) = 2. nCrCl2 = 2. 0,2 = 0,4 mol
nNaOH (3) = 0,5 – 0,4 = 0,1 mol
Theo (2): nCr(OH)3 = nCr(OH)2 = 0,2 mol
nCr(OH)3 còn lại sau phản ứng = 0,2 – 0,1 = 0,1 mol
mkết tủa = 0,1. 103 = 10,3 g
Bài giảng: Bài tập sắt, hợp chất của sắt tác dụng với chất oxi hóa mạnh - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Tính lưỡng tính của hợp chất Crom 3 (III)
- Tính oxi hóa của hợp chất Crom 6 (VI)
- Bài tập Đồng (Cu) tác dụng với axit sunfuric (H2SO4) đặc nóng, nitric acid (HNO3)
- Bài tập Đồng và hợp chất của đồng tác dụng với axit
- Bài tập Crom tác dụng với phi kim (Cl, O, S)
- Định nghĩa, tính chất, bài tập muối Crommat và muối Đicrommat
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

