Công thức tính nguyên tử khối trung bình là gì (chi tiết nhất)
Bài viết Công thức tính nguyên tử khối trung bình là gì lớp 7 chi tiết nhất là kiến thức có trong chương trình Khoa học tự nhiên 7 giúp học sinh nắm vững kiến thức trọng tâm về Công thức tính nguyên tử khối trung bình.
Công thức tính nguyên tử khối trung bình là gì (chi tiết nhất)
1. Công thức tính nguyên tử khối trung bình là gì?
Giả sử nguyên tố có hai đồng vị bền là A và B.
Gọi: là nguyên tử khối trung bình.
A, B lần lượt là nguyên tử khối của đồng vị A, đồng vị B.
a, b lần lượt là tỉ lệ phần trăm số nguyên tử của mỗi đồng vị A, B.
Ví dụ: Đồng có hai đồng vị bền là chiếm 73% và chiếm 27%. Nguyên tử khối trung bình của đồng là:
2. Kiến thức mở rộng
Mở rộng trong trường hợp nguyên tử có n đồng vị:
Với A1; A2… An lần lượt là nguyên tử khối của mỗi đồng vị A1; A2; …; An
a1, a2 … an lần lượt là tỉ lệ phần trăm số nguyên tử của mỗi đồng vị.
3. Bài tập minh họa
Câu 1: Neon có ba đồng vị bền trong tự nhiên. Tỉ lệ phần trăm số nguyên tử mỗi đồng vị được thể hiện trong bảng sau:
|
Số khối |
A |
21 |
22 |
|
Tỉ lệ (%) |
90,9 |
0,3 |
8,8 |
Biết rằng nguyên tử khối trung bình của Ne là 20,18. Giá trị số khối A của đồng vị đầu tiên là
A. 19,00.
B. 20,00.
C. 20,01.
D. Không xác định được.
Hướng dẫn giải
Đáp án B
Áp dụng công thức tính nguyên tử khối trung bình có:
→ A = 20
Câu 2: Trong tự nhiên, chlorine có hai đồng vị là và có tỉ lệ phần trăm số nguyên tử tương ứng là 75,76% và 24,24%. Nguyên tử khối trung bình của chlorine là (làm tròn đến chữ số thập phân thứ hai)
A. 35,84.
B. 36,12.
C. 35,48.
D. 36,21.
Hướng dẫn giải
Đáp án C
Nguyên tử khối trung bình của chlorine là
Câu 3: Đồng (copper) có hai đồng vị bền trong tự nhiên là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,55. Phần trăm số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là
A. 72,5% và 27,5%.
B. 27,5% và 72,5%
C. 25,0% và 75,0%.
D. 75,0% và 25,0%.
Hướng dẫn giải
Đáp án A
Gọi % số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là x và y (%).
Theo bài ra, ta có hệ phương trình:
Vậy phần số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là 72,5 và 27,5.
Câu 4: Biết rằng khí hiếm argon (kí hiệu Ar) có 3 đồng vị: (0,337%); (0,063%); (99,6%). Nguyên tử khối trung bình của argon là
A. 38,97.
B. 39,98.
C. 37,98.
D. 39,79.
Hướng dẫn giải
Đáp án B
Nguyên tử khối trung bình của argon là
Câu 5: Nguyên tố R có hai đồng vị, nguyên tử khối trung bình là 79,91. Một trong hai đồng vị là 79R (chiếm 54,5%). Nguyên tử khối của đồng vị thứ hai là
A. 80.
B. 81.
C. 82.
D. 80,5.
Hướng dẫn giải
Đáp án B
Gọi nguyên tử khối của đồng vị thứ hai là x
Câu 6: Trong tự nhiên iron (kí hiệu Fe hay gọi là sắt) có hai đồng vị là và . Nguyên tử khối trung bình của Fe bằng 55,85. Thành phần phần trăm số nguyên tử của mỗi đồng vị và lần lượt là
A. 15% và 85%.
B. 85% và 15%
C. 25% và 75%.
D. 75% và 25%.
Hướng dẫn giải
Đáp án A
Gọi % số nguyên tử của mỗi đồng vị và lần lượt là x và y (%).
Theo bài ra, ta có hệ phương trình
Vậy phần số nguyên tử của mỗi đồng vị và lần lượt là 15% và 85%.
Câu 7: Trong tự nhiên nguyên tố hydrogen có 3 đồng vị: , , . Hỏi có bao nhiêu loại phân tử H2 được tạo thành từ các loại đồng vị trên?
A. 3.
B. 6.
C. 9.
D. 12.
Hướng dẫn giải
Đáp án B
Trong phân tử H2, hai nguyên tử H có thể cùng là một đồng vị hoặc là hai đồng vị khác nhau (không phân biệt thứ tự) nên số loại phân tử có thể được tạo thành là = 6 (loại).
Câu 8: Trong tự nhiên hydrogen có 3 đồng vị: , , . Oxygen có 3 đồng vị ,, . Hỏi có bao nhiêu loại phân tử H2O được tạo thành từ các loại đồng vị trên?
A. 3.
B. 6.
C. 9.
D. 18.
Hướng dẫn giải
Đáp án D
Trong phân tử H2O
+ Hai nguyên tử H được chọn có thế giống nhau hoặc khác nhau (không phân biệt thứ tự) nên có 6 cách chọn.
+ Một nguyên tử O có 3 cách chọn.
Vậy có tất cả 6.3 = 18 loại phân tử H2O được tạo thành từ các đồng vị.
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều

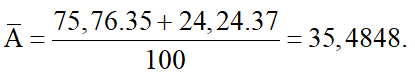
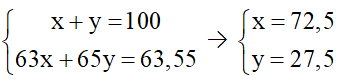
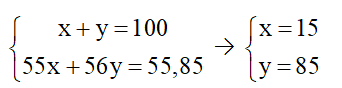



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

