Cách giải bài tập Kim loại tác dụng với axit, muối (hay, chi tiết)
Bài viết Cách giải bài tập Kim loại tác dụng với axit, muối với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách giải bài tập Kim loại tác dụng với axit, muối.
Cách giải bài tập Kim loại tác dụng với axit, muối (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập về kim loại tác dụng với muối - Cô Nguyễn Thị Thu (Giáo viên VietJack)
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
Với dung dịch axit
Phản ứng thuộc loại oxi hóa khử nên có thể vận dụng phương pháp bảo toàn electron.
Trong HCl,H2SO4 loãng:Cr và Fe bị H^+ của axit oxi hóa thành Cr2+,Fe2+ còn Cu không phản ứng.
Với H2SO4 đậm đặc,HNO3
+) Cu bị tan ra
+) Fe, Al, Cr bị thụ động trong HNO3 đặc nguội và H2SO4đặc nguội
- Với H2SO4 đặc nóng, HNO3 loãng,HNO3 đặc nóng,… Fe và Cr bị oxi hóa thành
Fe3+,Cr3+
+) S6+ và N5+ nếu bị khử về mức oxi hóa thấp hơn như SO2,NO, NO2,...
Chú ý: Nếu kim loại còn dư, thì thu được muối của sắt II và có thể muối sắt III dư.
Với dd Muối
- Vận dụng ý nghĩa của dãy điện thế cực chuẩn: Cr, Fe, Cu có thể đẩy kim loại yếu hơn ra khỏi muối như Ag, Hg...
- Với dạng bài tập: từ kim loại mạnh, tạo thành kim loại yếu hơn, có sự thay đổi về khối lượng nên vận dụng phương pháp tăng giảm khối lượng.
Ví dụ minh họa
Bài 1:Ngâm 15 gam hỗn hợp Fe và Cu trong dung dịch CuSO4 dư. Phản ứng xong thu được 16 gam chất rắn. Thành phần phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầu tương ứng là:
A. 53,34% và 46,66%
B. 46,67% và 53,33%
C. 40% và 60%
D. 60% và 40%
Lời giải:
Phương trình phản ứng:
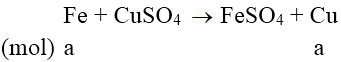
m tăng = (64 - 56).a = 1 ⇒ a = 0,125 mol
nFe = 0,125 ⇒ nCu = (15-56.0,125)/64 = 0,125 mol
Thành phần phần trăm theo khối lượng:
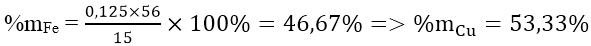
Bài 2: Cho 100 gam hợp kim của Fe, Cr, Al tác dụng với một lượng dư dung dịch NaOH thu được 4,98 lít khí. Lấy bã rắn không tan cho tác dụng với một lượng dư dung dịch HCl (không có không khí ) thu được 38,8 lít khí. Các thể tích khí đo ở đktc. Xác định thành phần % của hợp kim.
Lời giải:
Phản ứng:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (1)
Fe + 2HCl → FeCl2 + H2 (2)
Cr + 2HCl → CrCl2 + H2 (3)
Từ (1)⇒ nAl = 2/3 nH2 = 2/3.4,98/22,4 = 0,15(mol)
⇒ mAl = 0,15.27 = 4,05(gam)
⇒ mCr + Fe = 100 - 4,05 = 95,95(gam)
Gọi số mol Fe và Cr lần lượt là x và y mol
Theo đề bài ta có hệ phương trình:
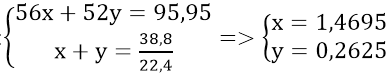
Vậy:
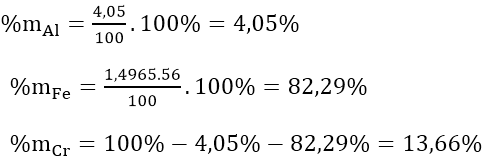
Bài 3: Nung nóng 16,8 gam hỗn hợp Au, Ag, Cu, Fe, Zn với một lượng dư khí O2, đến khi các phản ứng xảy ra hoàn toàn, thu được 23,2 gam chất rắn X. Thể tích dung dịch HCl 2M vừa đủ để phản ứng với chất rắn X là:
A. 600ml B. 200ml C. 800ml D. 400ml
Lời giải:
Theo ĐL bảo toàn khối lượng:
mO2 = 23,2 - 16,8 = 6,4 (g) ⇒ nO = 6,4/16 = 0,4 mol
Phản ứng của HCl với chất rắn X có thể được biểu diễn với sơ đồ:
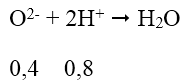
VHCl = 0,8 : 2 = 0,4 (lít) = 400ml
B. Bài tập trắc nghiệm
Bài 1: Cho 1,12 gam bột Fe và 0,24 gam bột Mg tác dụng với 250 ml dung dịch CuSO4, khuấy nhẹ cho đến khi phản ứng thực hiện xong. Khối lượng kim loại có trong bình phản ứng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 trước phản ứng.
A. 0,1M B. 0,15M C. 0,12M D. 0,2M
Lời giải:
Đáp án: A
Khối lượng kim loại tăng: 1,88 – (1,12 + 0,24) = 0,52 (gam)
Trước hết, Mg tác dụng với CuSO4:
Mg + CuSO4 → MgSO4 + Cu (1)
nMg = 0,1 mol ⇒ n CuSO4 = 0,1 mol
Từ (1) ⇒ 0,1 mol Mg tác dụng với 0,1 mol CuSO4, sinh ra 0,01 mol Cu đã làm cho khối lượng kim loại tăng: 0,01 .(64 – 24) = 0,4 (gam)
⇒ Phản ứng giữa Fe và CuSO4 làm cho khối lượng kim loại tăng:
0,52 - 0,40 = 0,12 (gam)
Fe + CuSO4 → FeSO4 + Cu
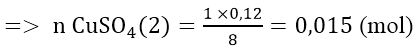
Vậy
Bài 2: Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 B. 240 C. 400 D. 120
Lời giải:
Đáp án: A
Số mol Fe = 0,02 mol; số mol Cu = 0,03 mol; số mol H+ = 0,4 mol; số mol NO3- = 0,08 mol
Các phản ứng xảy ra:
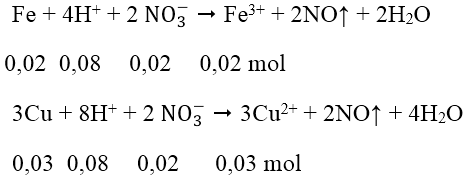
Sau 2 phản ứng trên, trong dung dịch X có 0,02 mol Fe3+; 0,03 mol Cu2+ và 0,24 mol H+ dư, ngoài ra còn có ion NO3- và SO42-. Tuy nhiên chỉ có 3 loai ion đầu là phản ứng với OH^-.
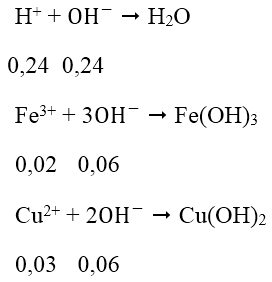
Tổng số mol OH- = 0,24 + 0,06 + 0,06 = 0,36 mol ⇒ V = 360ml
Bài 3: Hòa tan hoàn toàn 12 gam hỗn hợp Fe và Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít hỗn hợp X gồm(NO và NO2) và dung dịch Y chỉ chứa 2 muối và axit dư. Tỉ khối hơi của X đối với hidro bằng 19. Tính thể tích hỗn hợp khí X.
A. 2,24l B. 5,6l C. 4,48l D. 3,36l
Lời giải:
Đáp án: B
Ta có: 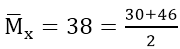
Có 56a + 64a = 12 ⇒ a = 0,1 mol ⇒ nFe = nCu = 0,1 mol

Áp dụng định luật bảo toàn electron : 4x = 0,5 ⇒ x = 0,125(mol)
Vậy : V = 0,125.2.22,4 = 5,6(lít)
Bài 4: Cho 4,15 gam hỗn hợp Fe, Al phản ứng với 200 ml dung dịch CuSO4 0,525M. khuấy kỹ hỗn hợp để phản ứng xảy ra hoàn toàn. Đem lọc kết tủa (A) gồm hai kim loại nặng 7,84 gam và dung dịch nước lọc B. Để hòa tan kết tủa A cần ít nhất bao nhiêu lit dung dịch HNO3 2M biết phản ứng tạo ra NO.
A. 0,12l B. 0,15 l C. 0,18l D. 0,2l
Lời giải:
Đáp án: C
Phản ứng xảy ra với Al trước, sau đó đến Fe. Theo giả thiết, kim loại sinh ra là Cu (kim loại hóa trị II).
Gọi x là số mol Al, y là số mol Fe phản ứng và z là số mol Fe dư:
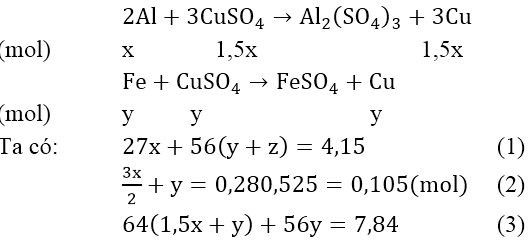
Phản ứng:
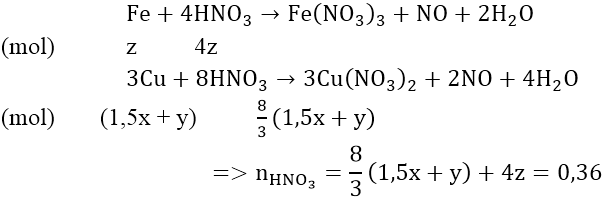
Vậy : VHNO3 = 0,36/2 = 0,18(lít)
Bài 5: Cho một hỗn hợp gồm có 1,12 gam Fe và 0,24 gam Mg tác dụng với 250 ml dung dịch CuSO4. Phản ứng thực hiện xong, người ta thu được kim loại có khối lượng là 1,88 gam. Tính nồng độ mol của dung dịch CuSO4 đã dùng.
A. 0,1M B. 0,12M C. 0,2M D. 0,05M
Lời giải:
Đáp án: A
Phương trình hóa học:
Mg + CuSO4 → MgSO4 + Cu (1)
Fe + CuSO4 → FeSO4 + Cu (2)
Có: nMg = 0,01 mol và nFe = 0,02 mol
Theo (1) và (2), nếu Mg và Fe phản ứng hết thì thu được 0,03 mol Cu.
Khối lượng kim loại thu được sau phản ứng là:
0,03 .64 = 1,92 (gam)
Thực tế chỉ thu được 1,88 gam kim loại. Chứng tỏ kim loại đã cho không phản ứng hết.
Mg có tính khử mạnh hơn Fe nên phản ứng trước.
Lượng Cu sinh ra ở (1) là 0,01 mol tương ứng với khối lượng 0,64 (gam)
Khối lượng Fe dư và Cu sinh ra ở (2) là: 1,88 – 0,64 = 1,24 (gam)
Đặt khối lượng Fe tham gia ở (2) là x, khối lượng sắt dư là (1,12 – 56x) và khối lượng Cu sinh ra ở (2) là 64x.
Ta có: (1,12 - 56x) + 64x = 1,24 ⇒ x = 0,015
Lượng CuSO4 trong 250 ml dung dịch đã phản ứng hết:
0,015 + 0,01 = 0,025(mol)
Nồng độ mol của dung dịch CuSO4 đã dùng là : 0,025/0,25 = 0,1mol|lít
Bài 6: Cho m1 gam Al vào 100 ml dung dịch gồm Cu(NO3)2 0,3M và AgNO3 0,3M. Sau khi các phản ứng xảy ra hoàn toàn thì thu đựơc m2 gam chất rắn X. Nếu cho m2 gam X tác dụng với lượng dư dung dịch HCl thì thu được 0,336 lít khí (đktc). Giá trị của m1 và m2 lần lượt là:
A. 8,10 và 5,43 B. 1,08 và 5,16
C. 0,54 và 5,16 D. 1,08 và 5,43.
Lời giải:
Đáp án: D
Ta có: nCu(NO3)2 = 0,03 mol; nAgNO3 = 0,03 mol; nH2 = 0,015 mol
Chất rắn X + dd HCl dư → H2 ⇒ trong chất rắn X có Al dư
Cu(NO3)2 và AgNO3 hết
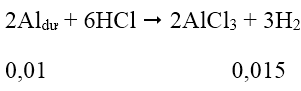
Al phản ứng hết với dd Cu(NO3)2 và AgNO3
Quá trình nhận e:

Tổng số mol e nhận = 0,06 + 0,03 = 0,09 mol
Quá trình nhường e:
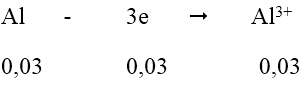
Vậy m2 = mAl dư + mCu + mAg = 0,01.27 + 0,03.64 + 0,03.108 = 5,43 gam
m1 = mAl ban đầu = (0,01 + 0,03).27 = 1,08g
Bài 7: Hòa tan hoàn toàn hỗn hợp gồm 0,01 mol Al; 0,05 mol Zn và 0,03 mol Fe cần vừa đủ 200ml dung dịch HCl 0,1M và H2SO4 a mol/l. Giá trị của a là?
A. 0,425 B. 0,5 C. 0,625 D. 0,75
Lời giải:
Đáp án: A
∑nH+ = 0,2.0,2 + 0,2.2a = 0 ,02 + 0,4a (mol)
∑ne cho = 0,01.3 + 0,05.2 + 0,03.2 = 0,19 (mol)
Ta có: ne cho = ne nhận = nH+
0,02 + 0,4a = 0,19 ⇒ a = 0,425
Bài 8: Cho 2,24g bột sắt vào 100ml dung dịch hỗn hợp gồm AgNO3 0,1M và Cu(NO3)2 0,5M khuấy đều cho tới khi phản ứng xảy ra hoàn toàn thu được chất rắn A và dung dịch B. Chất rắn A có khối lượng là:
A. 3,32g B. 4,4g C. 4,08g D. 5,4g
Lời giải:
Đáp án: C
Phản ứng xảy ra theo thứ tự:
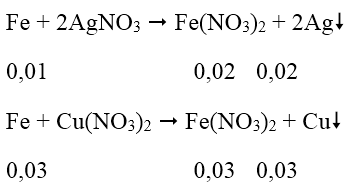
⇒ Fe tan hết
m = 0,02.108 + 0,03.64 = 4,08 (g)
Bài 9: Hòa tan m gam hỗn hợp A gồm Cu, Ag trong dung dịch HNO3 thu được dung dịch B chứa hỗn hợp 7,06g muối và 0,05 mol NO2 (duy nhất). Giá trị của m là:
A. 2,2 B. 3,06 C. 2,58 D. 3,96
Lời giải:
Đáp án: D
0,05 mol NO2 đã nhận 0,05 mol e
⇒ số mol điện tích (+) tạo ra là 0,05 mol ⇒ Số mol NO3- là 0,05 mol
m = mmuối - mNO3- = 7,06 - 0,05.62 = 3,96g
Bài 10: Đốt cháy hoàn toàn 3,86g hỗn hợp gồm Fe, Al, Cu thu được 4,66g oxit. Cho toàn bộ lượng oxit này tác dụng với dung dịch axit H2SO4 20% (d = 1,14 g/ml). Vậy thể tích H2SO4 cần dùng tối thiểu là:
A. 21,1 ml B.21,5 ml C. 23,4 ml D. 19,6 ml
Lời giải:
Đáp án: B
mO = moxit - mkim loại = 4,66 - 3,86 = 0,8g
nO = 0,8/16 = 0,05 mol
nO = 2nH+ = nH2SO4 = 0,05 mol
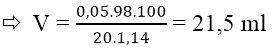
Bài giảng: Bài tập sắt, hợp chất của sắt tác dụng với chất oxi hóa mạnh - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Dạng 1: Chuỗi phản ứng hóa học của sắt, crom
- Dạng 2: Nhận biết, điều chế sắt và hợp chất của sắt
- Dạng 3: Sắt tác dụng với axit HNO3 và H2SO4 đặc nóng
- Dạng 5: Xác định tên kim loại và oxit kim loại
- Dạng 6: Phương pháp quy đổi trong hóa học vô cơ
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (cơ bản – phần 1)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

