Cách nhận biết, điều chế sắt và hợp chất của sắt (hay, chi tiết)
Bài viết Cách nhận biết, điều chế sắt và hợp chất của sắt với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Cách nhận biết, điều chế sắt và hợp chất của sắt.
Cách nhận biết, điều chế sắt và hợp chất của sắt (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài tập tổng hợp về sắt và hợp chất của sắt - Cô Nguyễn Thị Thu (Giáo viên VietJack)
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Dùng các phản ứng đặc trưng để nhận biết các chất
- Nắm vững các tính chất hóa học của các chất để giải thích các hiện tượng phản ứng.
Ví dụ minh họa
Bài 1: Hãy dùng 2 thuốc thử tự chọn để có thể phân biệt được các kim loại sau: Al, Fe, Mg, Ag. Trình bày cách nhận biết và viết các phương trình hóa học.
Lời giải:
Có thể chọn 2 thuốc thử là axit HCl và dung dịch kiềm NaOH
- Lấy vào mỗi ống nghiệm một ít bột kim loại đã cho.
- Nhỏ vào mỗi ống nghiệm một ít dung dịch HCl.
Ở ống nghiệm nào không có hiện tượng gì xảy ra đó là ống đựng kim loại Ag. Phản ứng xảy ra ở các ống nghiệm còn lại.
2Al + 6HCl → 2AlCl3 + 3H2↑
Fe + 2HCl → FeCl2 + H2↑
Mg + 2HCl → MgCl2 + H2↑
- Nhỏ từ từ dung dịch kiềm vào ống nghiệm chứa các dung dịch muối vừa thu được.
Ở ống nào thấy có kết tủa tạo thành rồi lại tan ra thì đó là ống chứa muối nhôm.
AlCl3 + 3NaOH → 3NaCl + Al(OH)3↓
Al(OH)3 + NaOH → Na[Al(OH)4]
Ở ống nào thấy có kết tủa màu trắng xanh, sau đó dần dần hóa nâu thì đó là ống chứa muối sắt, ta nhận ra kim loại sắt.
FeCl2 + 2NaOH → 2NaCl + Fe(OH)2↓ (trắng xanh)
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓ (nâu đỏ)
Ở ống nào thấy có kết tủa màu trắng không bị biến đổi thì đó là ống chứa muối magie, ta nhậ ra kim loại Mg.
MgCl2 + 2NaOH → 2NaCl + Mg(OH)2↓ (trắng)
Bài 2: Một hỗn hợp bột gồm Al, Fe, Cu. Hãy trình bày một phương pháp hóa học để tách từng kim loại ra khỏi hỗn hợp đó. Viết các phương trình hóa học của các phản ứng.
Lời giải:
Cho dung dịch NaOH dư vào hỗn hợp 3 kim loại thu được hai phần:
Phần dung dịch là NaAlO2 và NaOH dư.
Phần chất rắn là Cu và Fe
Al + NaOH + H2O → NaAlO2 + 3/2 H2
Lấy phần dung dịch dẫn CO2 đến dư thu được kết tủa Al(OH)3. Lọc lấy kết tủa đem nung ngoài không khí đến khối lượng không đổi thu chất rắn Al2O3. Điện phân nóng chảy Al2O3 ta được Al.
NaAlO2 + CO2 + H2O → NaHCO3 + Al(OH)3↓
CO2 + NaOH → NaHCO3
CO2 + 2NaOH → Na2CO3
2Al(OH)3 −tº→ Al2O3 + 3H2O
2Al2O3 −đpnc→ 4Al + 3O2
Phần chất rắn gồm Cu và Fe đem hòa tan trong HCl dư, thu được dung dịch là FeCl2 còn phần chất rắn là Cu. Điện phân dung dịch thu được ta được Fe.
Fe + 2HCl → FeCl2 + H2↑
FeCl2 −đpnc→ Fe + Cl2
Bài 3: Có các dung dịch muối: FeCl3, FeCl2, MgCl2, AlCl3, NaCl và NH4Cl. Để phân biệt các dung dịch muối clorua này có thể dùng thuốc thử nào dưới đây?
A. Dung dịch AgNO3 B. Dung dịch NH3
C. Dung dịch H2SO4 D. Dung dịch KOH
Lời giải:
Trích mẫu thử cho mỗi lần thí nghiệm. Nhỏ dung dịch KOH từ từ cho đến dư vào các mẫu thử:
- Mẫu nào xuất hiện kết tủa nâu ⇒ là dung dich FeCl3.
FeCl3 + 3KOH → Fe(OH)3 + 3KCl
- Mẫu nào xuất hiện kết tủa trắng dần hóa nâu đung dịch FeCl2.
FeCl2 + 2KOH → Fe(OH)2 + 2KCl
- Mẫu nào xuất hiện kết tủa trắng ⇒ dung dịch MgCl2.
MgCl2 + 2KOH → Mg(OH)2 + 2KCl
- Mẫu nào không có hiện tượng nào xảy ra ⇒ dung dịch NaCl.
- Mẫu nào xuất hiện kết tủa keo trắng, tan dần khi dư dung dịch KOH
⇒ dung dịch AlCl3.
AlCl3 + 3KOH → Al(OH)3 + 3KCl
Al(OH)3 + KOH → K[Al(OH)4]
- Mẫu nào có khí mùi khai bay ra ⇒ dung dịch NH4Cl.
KOH + NH4Cl → KCl + NH3 + H2O
Bài 4: Từ Fe, hãy trình bày 3 phương pháp điều chế trực tiếp muối FeSO4. Viết các phương trình hóa học.
Lời giải:
3 phương pháp hóa học điều chế trực tiếp FeSO4 từ Fe là:
Fe + H2SO4 → FeSO4 + H2
Fe + CuSO4 → FeSO4 + Cu
Fe + Fe2(SO4)3 → 3FeSO4
B. Bài tập trắc nghiệm
Bài 1: Hiện tượng gì xảy ra khi cho từ từ dung dịch NH3 vào dung dịch CuSO4?
A. Xuất hiện kết tủa màu xanh nhạt
B. Xuất hiện kết tủa màu xanh nhạt rồi tan thành dung dịch màu xanh đậm
C. Xuất hiện dung dịch màu xanh
D. Không có hiện tượng
Lời giải:
Đáp án: B
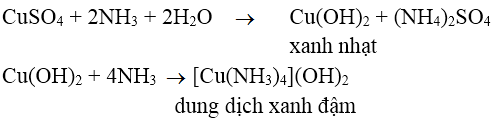
Bài 2: Hiện tượng gì xảy ra khi nhỏ một ít dung dịch KMnO4 vào dung dịch có chứa FeSO4 và H2SO4?
A. Xuất hiện màu tím hồng của dung dịch KMnO4
B. Mất màu tím hồng và xuất hiện màu vàng
C. Mất màu vàng và xuất hiện màu tím hồng
D. Cả A, B và c đều không đúng
Lời giải:
Đáp án: B
10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + K2SO4 + MnSO4 + 8H2O
Bài 3: Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4 vào dung dịch KMnO4. Hiện tượng quan sát được là
A. dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng
B. dung dịch màu tím hồng bị nhạt dần đến không màu
C. dung dịch màu tím hồng bị chuyển dần sang nâu đỏ
D. màu tím bị mất ngay. Sau đó dần dần xuất hiện trở lại thành dung dịch có màu hồng
Lời giải:
Đáp án: A
10FeSO4 + 8H2SO4 + 2KMnO4 → 5Fe2(SO4)3 + 2MnSO4 + 8H2O + K2SO4.
Chú ý muối Fe2(SO4)3 và FeCl3 có màu vàng
Bài 4: Hiện tượng gì xảy ra khi cho dung dịch NaOH vào ống nghiệm có chứa dung dịch FeCl2?
A. Xuất hiện màu nâu đỏ
B. Xuất hiện màu trắng xanh
C. Xuất hiện màu nâu đỏ rồi chuyển sang màu trắng xanh
D. Xuất hiện màu trắng xanh rồi chuyển sang màu nâu đỏ
Lời giải:
Đáp án: D
FeCl2 + 2NaOH → Fe(OH)2 (trắng xanh) + 2NaCl
4Fe(OH)2 + 2H2O + O2 → 4Fe(OH)3 (nâu đỏ)
Bài 5: Khi thêm dung dịch Na2CO3 vào dung dịch FeCl3 sẽ có hiện tượng gì xảy ra ?
A. Xuất hiện kết tủa màu nâu đỏ vì xảy ra hiện tượng thủy phân
B. Dung dịchvẫn có màu nâu đỏ vì chúng không phản ứng với nhau
C. Xuất hiện kết tủa màu nâu đỏ đồng thời có hiện tượng sủi bọt khí
D. Có kết tủa nâu đỏ tạo thành sau đó lại tan do tạo khí CO2
Lời giải:
Đáp án: C
Phương trình phản ứng:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓(đỏ nâu) + 3CO2↑ + 6NaCl
Bài 6: Để bảo quản dung dịch muối sắt (II) trong phòng thí nghiệm, người ta thường ngâm vào dung dịch đó
A. Một thanh Cu
B. Một thanh Zn
C. Một thanh Fe
D. Một thanh AI
Lời giải:
Đáp án: C
- Trong điều kiện thường Fe2+ dễ chuyển thành Fe3+
- Khi có Fe thì: Fe + 2Fe3+ → 3Fe2+
⇒ Do đó, trong dung dịch luôn có Fe2+
Bài 7: Cho vài giọt dung dịch H2S vào dung dịch FeCl3 hiện tượng xảy ra là
A. dung dịch xuất hiện kết tủa đen
B. có kết tủa vàng
C. kết tủa trắng hóa nâu
D. không hiện tượng gì
Lời giải:
Đáp án: B
H2S + 2FeCl3 → S↓(vàng) + 2FeCl2 + 2HCl
Bài 8: Cho vào ống nghiệm một ít tinh thể K2Cr2O7, sau đó cho nước vào và khuấy đều để K2Cr2O7 tan hết, thu được dung dịch X. Thêm vài giọt dung dịch KOH vào dung dịch X, thu được dung dịch Y. Màu của dung dịch X và Y lần lượt là:
A. Màu vàng và màu da cam
B. Màu nâu đỏ và màu vàng
C. Màu da cam và màu vàng
D. Màu vàng và màu nâu đỏ
Lời giải:
Đáp án: C
Trong dung dịch K2Cr2O7 (màu da cam) có cân bằng:
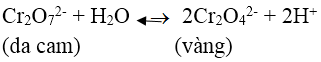
Khi thêm dung dịch KOH vào, OH- trung hòa H+ làm cân bằng chuyển dịch sang phải tạo ra CrO42- có màu vàng
C. Bài tập tự luyện
Câu 1: Hiện tượng nào dưới đây được mô tả không đúng?
A. Thêm NaOH vào dung dịch FeCl3 màu vàng nâu thấy xuất hiện kết tủa đỏ nâu.
B. Thêm một ít bột Fe vào lượng dư dung dịch AgNO3 thấy xuất hiện dung dịch có màu xanh nhạt.
C. Thêm Fe(OH)3 màu đỏ nâu vào dung dịch H2SO4 thấy hình thành dung dịch có màu vàng nâu.
D. Thêm Cu vào dung dịch Fe(NO3)3 thấy dung dịch chuyển từ màu vàng nâu sang màu xanh.
Câu 2: Cho dây sắt quấn hình lò xo (đã được nung nóng đỏ) vào lọ đựng khí chlorine. Hiện tượng xảy ra là
A. Sắt cháy tạo thành khói trắng dày đặt bám vào thành bình.
B. Không thấy hiện tượng phản ứng.
C.Sắt cháy sáng tạo thành khói màu nâu đỏ.
D. Sắt cháy sáng tạo thành khói màu đen.
Câu 3: Nhận biết các dung dịch muối: Fe2(SO4)3 , FeSO4, FeCl3 ta có thể dùng hóa chất nào trong các hóa chất sau đây ?
A. Dung dịch BaCl2.
B. Dung dịch BaCl2 và dung dịch NaOH.
C. Dung dịch AgNO3.
D. Dung dịch NaOH.
Câu 4: Để phân biệt Fe, hỗn hợp (FeO và Fe2O3) và hỗn hợp (Fe, Fe2O3) ta có thể dùng
A. Dung dịch HNO3, dung dịch NaOH.
B. Dung dịch HCl, dung dịch NaOH.
C. Dung dịch NaOH, Cl2.
D. Dung dịch HNO3, Cl2.
Câu 5: Có hỗn hợp 3 kim loại Al, Fe, Zn. Hoá chất có thể dùng để tách Fe khỏi hỗn hợp là
A. Dung dịch kiềm.
B. Dung dịch H2SO4 đặc, nguội.
C. Dung dịch Fe2(SO4)3.
D. Dung dịch HNO3 đặc, nguội.
Bài giảng: Bài tập sắt, hợp chất của sắt tác dụng với chất oxi hóa mạnh - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Dạng 1: Chuỗi phản ứng hóa học của sắt, crom
- Dạng 3: Sắt tác dụng với axit HNO3 và H2SO4 đặc nóng
- Dạng 4: Kim loại tác dụng với axit, muối
- Dạng 5: Xác định tên kim loại và oxit kim loại
- Dạng 6: Phương pháp quy đổi trong hóa học vô cơ
- 150 câu trắc nghiệm Crom, Sắt, Đồng có lời giải (cơ bản – phần 1)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

