Cách nhận biết một số chất khí (hay, chi tiết nhất)
Bài viết Cách nhận biết một số chất khí hay, chi tiết giúp bạn nắm vững kiến thức trọng tâm về Cách nhận biết một số chất khí.
Cách nhận biết một số chất khí
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Bài 41: Nhận biết một số chất khí - Cô Nguyễn Thị Thu (Giáo viên VietJack)
I. Nguyên tắc chung
Có thể dựa vào tính chất vật lý hoăc tính chất hóa học đặc trưng của nó như màu, mùi, khả năng tạo kết tủa với các chất khác.
II. Nhận biết một số chất khí
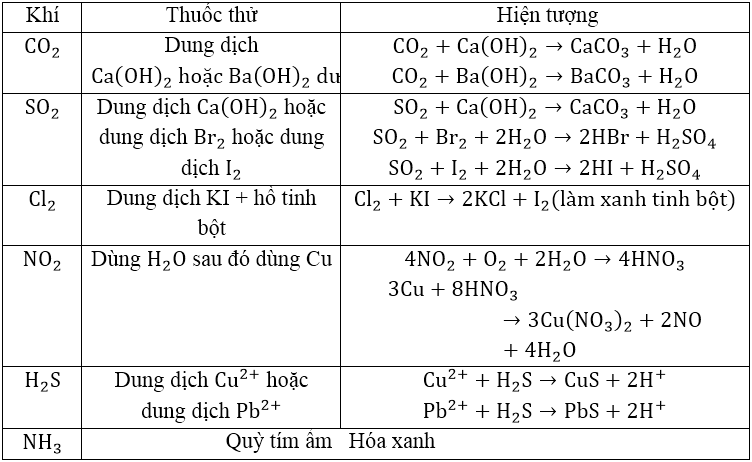
1. Nhận biết khí CO2
- Không màu, không mùi nặng hơn không khí, ít tan trong nước, làm đục nước vôi trong
- Khi thêm Ca(OH)2 dư/ Ba(OH)2 dư tạo kết tủa trắng
CO2 + Ca(OH)2 → CaCO3 + H2O
2. Nhận biết khí SO2
- Không màu, nặng hơn không khí, có mùi hắc, gây ngạt và độc, làm đục nước vôi trong giống CO2
- Làm nhạt màu dung dịch nước brom hoặc dung dịch iot.
SO2 + Br2 + 2H2O → 2HBr + H2SO4
SO2 + I2 + 2H2O → 2HI + H2SO4
3. Nhận biết khí Clo
- Màu vàng lục, mùi hắc, độc, ít tan trong nước
- Nhận biết bằng giấy tẩm KI và hồ tinh bột. Do phản ứng tạo ra I2 gặp hồ tinh bột tạo màu xanh tím.
Cl2 + KI → 2KCl + I2 (làm xanh tinh bột)
4. Nhận biết khí NO2
- Màu nâu đỏ, độc, ít tan trong nước. Có thể nhận biết qua màu nâu đỏ khi nồng độ NO2 đủ lớn.
4NO2 + O2 + 2H2O → 4HNO3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
5. Nhận biết khí H2S
- Không màu, mùi trứng thối, độc.
- Tạo muối sunfua kết tủa có màu với nhiều dung dịch muối
Cu2+ + H2S → CuS + 2H+
Pb2+ + H2S → PbS + 2H+
6. Nhận biết khí NH3
- Không màu, tan nhiều trong nước, mùi khai đặc trưng.
- Làm xanh quỳ tím ẩm
BẢNG TỔNG HỢP NHẬN BIẾT CHẤT KHÍ
III. Ví dụ minh họa
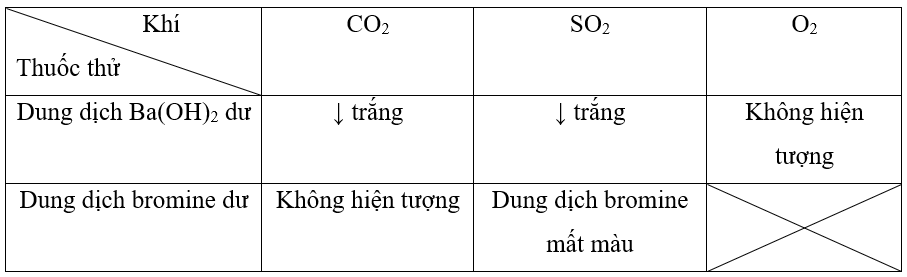
Ví dụ 1: Bằng phương pháp hóa học hãy nhận biết các khí sau: CO2, SO2, O2.
Dẫn các khí qua dung dung dịch Ba(OH)2 dư, 2 khí tạo kết tủa khi phản ứng với dung dịch là CO2 và SO2 còn lại không hiện tượng là O2.
CO2 + Ba(OH)2 ⟶ BaCO3↓ + H2O;
SO2 + Ba(OH)2 ⟶ BaSO3↓ + H2O.
Dẫn 2 khí ở trên qua dung dịch bromine dư, khí nào làm mất màu dung dịch là SO2.
SO2 + Br2 + 2H2O → 2HBr + H2SO4.
Ví dụ 2: Chỉ dùng quỳ tím ẩm hãy nhận biết các khí sau: NH3, O2, CO2, Cl2.
Trong dung dịch nước:
NH3 + H2O ⇌ + OH− (môi trường base).
CO2 + H2O ⇌ + H+ (môi trường acid).
Cl2 + H2O ⇌ HCl + HClO (tính oxi hóa ở HClO).
IV. Bài tập tự luyện
Câu 1: Thổi một mẫu thử chứa duy nhất một khí X (có thể là một trong bốn khí: N2, NH3, CH4, CO) lần lượt qua CuO đốt nóng, CuSO4 khan và bình đựng nước vôi trong. Sau thí nghiệm thấy CuSO4 qua màu xanh và bình chứa Ca(OH)2 không có hiện tượng gì. X là
A. N2.
B. NH3.
C. CH4.
D. CO.
Câu 2: Cách nhận biết khí ammonia là
A. dùng quỳ tím ẩm.
B. dùng dung dịch NaOH.
C. dùng dung dịch HCl loãng.
D. dùng dung dịch NaCl.
Câu 3: Để phân biệt ba bình khí mất nhãn lần lượt chứa các khí N2, O2 và O3, một học sinh đã dùng các thuốc thử (có trật tự) theo bốn cách dưới đây. Cách nào là không đúng?
A. Lá Ag nóng, que đóm còn tàn đỏ.
B. Que đóm còn tàn đỏ, lá Ag nóng.
C. Dung dịch KI/hồ tinh bột, que đóm còn tàn đỏ.
D. Dung dịch KI/hồ tinh bột, lá Ag nóng.
Câu 4: Để phân biệt khí CO2 và khí SO2, có thể dùng
A. dung dịch Br2.
B. dung dịch NaOH.
C. dung dịch KNO3.
D. dung dịch Ca(OH)2.
Câu 5: Để phân biệt hai khí SO2 và H2S thì nên sử dụng thuốc thử nào dưới đây?
A. Dung dịch KMnO4.
B. Dung dịch Br2.
C. Dung dịch CuCl2.
D. Dung dịch NaOH.
Câu 6: Nhận biết khí SO2 ta dùng dung dịch nước Br2 dư hiện tượng xảy ra là
A. Dung dịch Br2 mất màu.
B. Dung dịch Br2 chuyển sang màu da cam.
C. Dung dịch Br2 chuyển sang màu xanh.
D. Không hiện tượng.
Câu 7: Có 5 bình mất nhãn, chứa riêng biệt các khí SO2, SO3, N2, CH3NH2 và NH3. Nếu chỉ dùng quỳ tím ẩm thì có thể nhận ra bình chứa khí
A. SO2.
B. SO3.
C. N2.
D. NH3.
Câu 8: Chỉ dùng thuốc thử nào sau đây có thể nhận biết được cả 3 khí Cl2, HCl và O2?
A. Giấy tẩm dung dịch phenolphthalein.
B. Tàn đóm hồng.
C. Giấy quỳ tím khô.
D. Giấy quỳ tím ẩm.
Câu 9: Dẫn hỗn hợp khí gồm CO2, O2, N2 và H2 qua dung dịch NaOH. Khí bị hấp thụ là
A. H2.
B. CO2.
C. N2.
D. O2.
Câu 10: Cho kim loại đồng tác dụng với dung dịch HNO3 loãng thu được khí X không màu hóa nâu trong không khí. X là
A. N2.
B. NO2.
C. NO.
D. H2.
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các phần Lý thuyết Hóa học lớp 12 ôn thi Tốt nghiệp THPT hay khác:
- Lý thuyết Nhận biết một số cation trong dung dịch
- Lý thuyết Nhận biết một số anion trong dung dịch
- Lý thuyết Nhận biết một số chất khí
- Lý thuyết Chuẩn độ axit - bazo, chuẩn độ oxi hóa - khử
- Dạng 1: Các dạng bài tập về nhận biết, tách chất
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều





 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

