Các dạng bài tập về nhận biết, tách chất cực (hay, chi tiết)
Bài viết bài tập về nhận biết, tách chất với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập bài tập về nhận biết, tách chất.
Các dạng bài tập về nhận biết, tách chất cực (hay, chi tiết)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Phân biệt một số chất vô cơ - Cô Nguyễn Thị Thu (Giáo viên VietJack)
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
1. Phản ứng nhận biết
Phản ứng nhận biết phải là phản ứng đặc trưng, tức là phản ứng xảy ra:
- Nhanh (phản ứng xảy ra tức thời).
- Nhạy (một lượng nhỏ cũng phát hiện được).
- Dễ thực hiện (điều kiện nhiệt độ, áp suất thấp).
- Phải có dấu hiệu, hiện tượng dễ quan sát (tạo kết tủa, hòa tan kết tủa, thay đổi màu, sủi bọt khí, có mùi,...). Không được dùng phản ứng không có dấu hiệu, hiện tượng dễ nhận biết.
2. Cách trình bày bài giải bài tập nhận biết
+) Cách 1: Phương pháp mô tả
- Bước 1: Trích mẫu thử từ hóa chất cần nhận biết.
- Bước 2: Chọn thuốc thử (tùy theo yêu cầu của đề bài; thuốc thử tùy chọn không hạn chế, hay hạn chế, hoặc không dùng thuốc thử bên ngoài,...).
- Bựớc 3: Cho thuốc thử vào mẫu thử, trình bày hiện tượng quan sát được (mô tả hiện tượng xảy ra) rút ra kết luận đã nhận biết được hóa chất nào.
- Bước 4: Viết phương trình phản ứng xảy ra khi nhận biết.
+) Cách 2: Dùng phương pháp lập bảng
Cũng qua các bước như cách 1. Riêng bước 2 và 3 thay vì mô tả, gộp lại thành bảng: trình tự nhận biết.
Ví dụ:
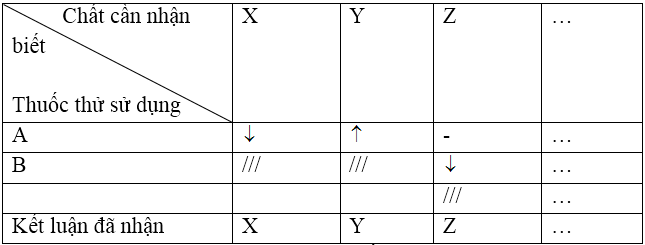
Chú ý: Kí hiệu (-) quy ước: không có dấu hiệu gì xảy ra (mặc dù có thể có phản ứng), (///) chất đã nhận biết được.
Sau cùng phải viết các phương trình phản ứng xảy ra khi nhận biết, cần lưu ý sự khác nhau giữa nhận biết và phân biệt. Để phân biệt các chất X, Y, Z, T chỉ cần nhận biết các chất Z, Y, Z, chất còn lại đương nhiên là Z. Ngược lại, để nhận biết các chất X, Y, Z, T phải xác định đủ tất cả các chất này, không được bỏ qua chất nào.
3. Các kiểu bài nhận biết
a) Kiểu bài không hạn chế thuốc thử
Dạng này có thể dùng nhiều thuốc thử khác nhau để nhận biêt, miễn sao hợp lí.
b) Dùng thuốc thử hữu hạn
Dạng này chỉ được dùng những thuốc thử mà đề cho hay đề yêu cầu, dùng quá là sai. Để giải dạng toán này ta có một số điểm lưu ý sau:
- Có thể dùng chất đã nhận biết trở lại làm thuốc thử.
- Trong dung dịch các muối nhận biết có các ion Al3+, Zn2+, Cr3+, Sn2+, Pb2+, Cu2+, Mg2+, Fe2+, Fe3+, NH4+ ta dùng kiềm.
- Trong các dung dịch nhận biết vừa có môi trường axit vừa có môi trường bazơ, ta dùng quỳ tím.
- Các dung dịch nhận biết có dung dịch muối HCO3-, HSO3- ta đun nóng nhẹ dung dịch để nhận biết thông qua hiện tượng có khí bay ra.
2HCO3- → H2O + CO32- + CO2
c) Không dùng thuốc thử
Dạng này không được dùng bất cứ một thuốc thử nào, có dùng là sai.
Để giải dạng toán này ta lưu ý một số điểm sau:
- Trong các dung dịch muối nhận biết có muối HCO3-, HSO3- ta đun nóng các mẫu dung dịch muối này, thông qua hiện tượng khí bay ra hay kết tủa để nhận biết, rồi dùng nó trở lại làm thuốc thử.
2NaHCO3 −tº→ Na2CO3 + CO2 + H2O
Ca(HCO3)2 −tº→ CaCO3 + CO2 + H2O
- Nguyên tắc chung để giải dạng toán này là cho các chất tác dụng lẫn nhau từng dôi một rồi lập bảng quan sát hiện tượng để kết luận (Qui tắc này gọi là qui tắc bóng đá vòng tròn).
d. Dạng nhận biết các chất cùng nằm trong một hỗn hợp:
Nguyên tắc để giải dạng toán này cũng như trên, chỉ lưu ý rằng là khi nhận biết được chất nào thường loại nó ra khỏi hỗn hợp và nhận biết đến cùng.
Lưu ý: Với dạng bài tách chất
- Có hỗn hợp nhiều chất trộn lẫn với nhau, dùng phản ứng hóa học kết hợp với sự tách, chiết, đun sôi, cô cạn để tách một chất ra khỏi hỗn hợp hay tách các chất ra khỏi nhau.
- Dạng toán này chỉ cần tách riêng một chất ra khỏi hỗn hợp, loại bỏ các chất khác, ta có một trong hai cách giải sau:
Cách 1: Dùng hóa chất phản ứng tác dụng lên các chất cần loại bỏ, còn chất cần tách riêng không tác dụng sau phản ứng được tách ra dễ dàng.
Cách 2: Dùng hóa chất tác dụng với chất cần muốn tách riêng tạo ra sản phẩm mới. sản phẩm dễ tách khỏi hỗn hợp và dễ tái tạo lại chất đầu.
Ví dụ minh họa
Bài 1: Cho ba dung dịch đựng trong ba lọ riêng biệt: CuSO4, Cr2(SO4)3 và FeSO4. Thuốc thử nào sau đây có thể phân biệt được cả ba lọ hóa chất trên?
A. HCl B. H2SO4 C.NaOH D. Ba(OH)2
Lời giải:
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch NaOH lần lượt vào các mẩu thử.
- Mẩu thử tạo kết tủa màu xanh là CuSO4.
CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
- Mẩu thử tạo kết tủa trắng xanh, sau đó hóa nâu đỏ là FeSO4.
FeSO4 + 2NaOH →Fe(OH)2 + Na2SO4
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
- Mẩu thử tạo kết tủa xanh rêu, sau đó tan trong kiềm dư là Cr2(SO4)3.
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 + 3Na2SO4
Cr(OH)3 + NaOH → Na[Cr(OH)4]
Bài 2: Cho 5 lọ mất nhãn đựng các dung dịch : KNO3, Cu(NO3)2, FeCl3 và NH4Cl. Chỉ sử dụng duy nhất một thuốc thử, hãy nhận biết các dung dịch trên
Lời giải:
Trích mẫu thử cho mỗi lần thí nghiệm. cho dung dịch NaOH lần lượt vào các mẫu thử.
Mẫu thử tạo kết tủa xanh là Cu(NO3)2
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
Mẫu thử tạo kết tủa nâu đỏ là FeCl3
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Mẫu thử tạo kết tủa keo trắng tan trong kiềm dư là AlCl3
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → Na[Al(OH)4]
Mẫu thử có khí mùi khai bay ra là NH4Cl
NH4Cl + NaOH → NaCl + NH3 + H2O
Bài 3: Có 5 bình mất nhãn đựng 5 dung dịch sau: HCl, H2SO4, BaCl2, Na2SO4, Ca(HCO3)2. Hãy nhận biết hình nào đựng dung dịch gì?(mà không dùng bất cứ thuốc thử nào)?
Lời giải:
Đun nhẹ 5 mẫu dung dịch trong 5 ống nghiệm, mẫu nào có sủi bọt khí và có kết tủa là Ca(HCO3)2
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Dùng dung dịch Ca(HCO3)2 vừa nhận biết trở lại làm thuốc thử tác dụng với 4 mẫu dung dịch còn lại
Mẫu nào có khí bay ra không có kết tủa là HCl
Ca(HCO3)2 + 2HCl → CaCl2 + H2O + CO2
Mẫu nào vừa có khí vừa có kết tủa là H2SO4
Ca(HCO3)2 + 2H2SO4 → CaSO4 + H2O + CO2
Mẫu nào chỉ có kết tủa không có khí là Na2CO3
Ca(HCO3)2 + 2Na2CO3 → CaCO3 + 2NaHCO3
Mẫu nào không có hiện tượng gì là BaCl2
Bài 4: Một loại muối ăn bị lẫn các tạp chất là Na2SO4, NaBr, MgCl2, CaCl2 và CaSO4. Hãy trình bày phương pháp hóa học để thu được NaCl tinh khiết.
Lời giải:
Hòa tan vào nước, thêm BaCl2 dư để loại muối SO42-
Lọc bỏ kết tủa, lấy nước lọc cho thêm Na2CO3 dư để loại hết các cation Ca2+, Mg2+, Ba2+.
Lọc bỏ kết tủa, lấy nước lọc sục Cl2 dư vào để loại anion Br-
Cl2 + 2NaBr → 2NaCl + Br2
Vì chỉ có một lượng nhỏ Cl2 tác dụng với nước , do đó phải cho thêm dung dịch HCl dư để loại hết CO32-.
CO32- + 2H+ → CO2 + H2O
Cô cạn dung dịch được NaCl tinh khiết.
B. Bài tập trắc nghiệm
Bài 1: Có 5 dung dịch riêng rẽ, mỗi dung dịch chứa một cation: NH4+, Mg2+, Fe3+, Al3+, Na+ có nồng độ khoảng 0,1M. Nếu dùng dung dịch NaOH thì có thể nhận biết được mấy dung dịch?
A. 3 B. 4 C. 5 D. 2
Lời giải:
Đáp án: B
Các phản ứng xảy ra:
NH4^+ + OH- → NH3↑ + H2O
Mg2+ + 2OH- → Mg(OH)2↓ tủa trắng
Fe3+ + 3OH- → Fe(OH)3↓ nâu đỏ
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3 + 3 OH- → [Al(OH)4]- tan
Nhận biết được 4 dung dịch.
Bài 2: Không dùng hóa chất hãy nhân biết 4 dung dịch sau trong bốn bình bị mất nhãn: HCl, H2SO4, Na2CO3, BaCl2
Lời giải:
Đáp án:
Trích mỗi dung dịch một ít làm mẫu thử. Lấy ngẫu nhiên một mẫu thử rồi cho tác dụng lần lượt với các mẫu thử còn lại. ta có bảng sau.
| Mẫu | HCl | H2SO4 | Na2CO3 | BaCl2 |
| HCl | Kt | |||
| H2SO4 | Kt | Kt | ||
| Na2CO3 | Kt | Kt | Kt | |
| BaCl2 | Kt | Kt |
Dựa vào bảng trên ta thấy
Chất tác dụng với 3 chất kia cho một kết tủa và hai khi là Na2CO3
Chất tác dụng với 3 chất kia cho hai kết tủa là BaCl2
Chất tác dụng với 3 chất kia cho một kết tủa, một khí là H2SO4
Chất tác dụng với 3 chất kia chỉ cho một khí là HCl
2HCl + Na2CO3 → 2NaCl + H2O + CO2
H2SO4 + Na2CO3 → Na2SO4 + H2O + CO2
BaCl2 + Na2CO3 → BaCO3 + 2NaCl
BaCl2 + H2SO4 → BaSO4 + 2HCl
Pb2+ + CO32- → PbCO3
Bài 3: Có 5 dung dịch mất nhãn gồm CuCl2, NaNO3, Mg(NO3)2; NH4NO3 và Fe(NO3)3. Có thể dùng kim loại nào sau đây để phân biệt cả 5 dung dịch?
A. Na B. Fe C. Cu D. Ag
Lời giải:
Đáp án: A
Dùng Na
Na + H2O → NaOH + ½ H2
Sau đó:
CuCl2 + 2NaOH → Cu(OH)2↓ (xanh) + 2NaCl
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ (trắng) + 2NaNO3
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
Fe(NO3)3 + 3NaOH → Fe(OH)3↓ (nâu đỏ) + 3NaNO3
Bài 4: Có hai dung dịch (NH4)2S và (NH4)2SO4. Dùng dung dịch nào sau đây để nhận biết được cả hai dung dịch trên?
A. Dung dịch NaOH. B. Dung dịch Ba(OH)2.
C. Dung dịch KOH. D. Dung dịch HCl.
Lời giải:
Đáp án: B
Có khí mùi khai là (NH4)2S
Có khí mùi khai và kết tủa trắng là (NH4)2SO4
(NH4)2S + Ba(OH)2 → BaS + 2NH3↑ + 2H2O
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3↑ + 2H2O
Bài 5: Trong nước tự nhiên thường có lẫn những lượng nhỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2 và Mg(HCO3)2. Có thể dùng một hóa chất nào sau đây để loại được tất cả các muối trên?
A. NaOH B. Na2CO3 C. NaHCO3 D. K2SO4
Lời giải:
Đáp án: B
Khi cho Na2CO3 vào loại nước trên thì sẽ tạo kết tủa trắng CaCO3 và MgCO3
Bài 6: Có dung dịch hỗn hợp chứa các ion Fe3+, Al3+, Cu2+. Dùng những dung dịch nào sau đây có thể tách riêng từng ion ra khỏi hỗn hợp?
A. Dung dịch NaOH, NH3. B. Dung dịch NaOH, NH3, HCl
C. Dung dịch NaOH, HCl, H2SO4 D. Dung dịch Ba(OH)2, NaOH, NH3.
Lời giải:
Đáp án: B
Tách các chất theo sơ đồ sau:
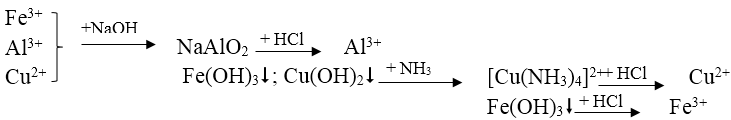
Bài 7: Cho năm lọ mất nhãn đựng các dung dịch: KNO3, Cu(NO3)2, FeCl3 và NH4C1. Có thể dùng hóa chất nào sau đây để nhận biết chúng?
A. Dung dịch NaOH dư B. Dung dịch AgNO3
C. Dung dịch Na2SO4 D. Dung dịch HC1
Lời giải:
Đáp án: A
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch NaOH lần lượt vào các mẩu thử.
- Mẩu thử tạo kết tủa xanh là Cu(NO3)2.
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
- Mẩu thử tạo kết tủa nâu đỏ là FeCl3.
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
- Mẩu thử tạo kết tủa keo trắng tan trong kiềm dư là A1C13.
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → Na[Al(OH)4]
- Mẩu thử có khí mùi bay ra là NH4Cl.
NH4Cl+ NaOH → NaCl + NH3 + H2O
Bài 8: Cho ba hợp kim: Cu-Ag, Cu-Al, Cu-Zn. Thuốc thử nào sau đây có thể được dùng để phân biệt ba hợp kim trên?
A HCl và NaOH
B. HNO3 và NH3
C. H2SO4 và NaOH
D. H2SO4 loãng và NH3
Lời giải:
Đáp án: D
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 lần lượt vào các mẩu thử.
- Hợp kim nào không có khí là Cu-Ag.
- Cho dung dịch NH3 vào dung dịch thu được trong hai trường hợp còn lại.
+) Trường hợp tạo kết tủa keo trắng và không tan trong NH3 dư ⇒ hợp kim là Cu-Al.
3A1 + 3H2SO4 → A12(SO4)3 + 3H2
A12(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
+) Trường hợp tạo kết tủa rồi tan trong NH3 dư ⇒ hợp kim ban đầu là Cu-Zn.
Zn + H2SO4 → ZnSO4 + H2
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Bài 9: Để phân biệt hai khí SO2 và H2S thì nên sử dụng thuốc thử nào dưới đây?
A. Dung dịch KMnO4
B. Dung dịch Br2
C. Dung dịch CuCl2
D. Dung dịch NaOH
Lời giải:
Đáp án: C
H2S tạo kết tủa đen với CuCl2.
H2S + CuCl2 → CuS + 2HC1
Bài 10: Có 5 bình mất nhãn, chứa riêng biệt các khí SO2, SO3, N2, CH3NH2 và NH3. Nếu chỉ dùng quỳ tím ẩm thì có thể nhận ra bình chứa khí:
A. SO2 B. SO3 C. N2 D. NH3
Lời giải:
Đáp án: C
SO2 và SO3 làm quỳ tím ẩm hóa đỏ.
CH3NH2 và NH3 làm quỳ tím hóa xanh.
N2 không làm đổi màu quỳ tím.
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Dạng 2: Các bài toán về chuẩn độ axit bazo, chuẩn độ oxi hoa khử
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (cơ bản – phần 1)
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (cơ bản – phần 2)
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (nâng cao – phần 1)
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (nâng cao – phần 2)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

