40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (nâng cao – phần 2)
Với 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải chi tiết sẽ giúp học sinh ôn tập, biết cách làm câu trắc nghiệm Phân biệt một số chất vô cơ.
40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (nâng cao – phần 2)
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Bài giảng: Phân biệt một số chất vô cơ - Cô Nguyễn Thị Thu (Giáo viên VietJack)
Câu 21. Có hai dung dịch (NH4)2S và (NH4)2SO4. Dùng dung dịch nào sau đây để nhận biết được cả hai dung dịch trên?
A. Dung dịch NaOH.
B. Dung dịch Ba(OH)2.
C. Dung dịch KOH.
D. Dung dịch HCl.
Lời giải:
Dùng Ba(OH)2
Có khí mùi khai là (NH4)2S
Có khí mùi khai và kết tủa trắng là (NH4)2SO4
(NH4)2S + Ba(OH)2 → BaS + 2NH3↑ + 2H2O
(NH4)2SO4 + Ba(OH)2 → BaSO4 + 2NH3↑ + 2H2O
→ Đáp án B
Câu 22. Cho ba hợp kim: Cu-Ag, Cu-Al, Cu-Zn. Thuốc thử nào sau đây có thể được dùng để phân biệt ba hợp kim trên?
A. HCl và NaOH
B. HNO3 và NH3
C. H2SO4 và NaOH
D. H2SO4 loãng và NH3
Lời giải:
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 lần lượt vào các mẩu thử.
- Hợp kim nào không có khí là Cu-Ag.
- Cho dung dịch NH3 vào dung dịch thu được trong hai trường hợp còn lại.
+ Trường hợp tạo kết tủa keo trắng và không tan trong NH3 dư ⇒ hợp kim là Cu-Al.
3Al + 3H2SO4 → Al2(SO4)3 + 3H2
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
+ Trường hợp tạo kết tủa rồi tan trong NH3 dư ⇒ hợp kim ban đầu là Cu-Zn.
Zn + H2SO4 → ZnSO4 + H2
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
→ Đáp án D
Câu 23. Có 3 ống nghiệm riêng rẽ, mỗi ống chứa một trong các ion sau: SO42-, SO32-, CO32-. Có thể dùng những hóa chất nào trong dãy sau đây để nhận biết từng ion?
A. Dung dịch Ca(OH)2.
B. Dung dịch HCl, dung dịch Br2 và BaCl2.
C. Dung dịch HCl, dung dịch Br2 và NaOH.
D. Dung dịch HCl, dung dịch Ca(OH)2.
Lời giải:
Trước hết cho HCl vào từng dung dịch
CO32- + 2H+ → CO2↑ + H2O
SO32- + 2H+ → SO2↑ + H2O
Nhận biết SO2 bằng dung dịch Br2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Nhận biết SO42- bằng dung dịch BaCl2
Ba2+ + SO42- → BaSO4↓
→ Đáp án B
Câu 24. Để xác định hàm lượng FeCO3 trong quặng xi đe rit, người ta làm như sau: còn 0,6g mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4 trong môi trường H2SO4 loãng. Chuẩn đọ dung dịch thu được bằng dung dịch chuẩn KMnO4 0,025M thì dùng vừa hết 25,2ml. % theo khối lượng của FeCO3 là:
A. 12,18% B. 24,26%
C. 60,9% D. 30,45%
Lời giải:
nKMnO4 = (0,025.25,2)/1000 = 6,3.10-4 mol
Phương trình phản ứng:
10FeSO4 (3,15.10-3) + 8H2SO4 + 2KMnO4 (6,3.10-4) → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
mFeCO3 = 3,15.10-3. 116 = 0,3654g
%FeCO3 = (0,3654/0,6). 100% = 60,9%
→ Đáp án C
Câu 25. Chỉ dùng quỳ tím thì nhận ra được bao nhiêu dung dịch trong số bốn dung dịch mất nhãn: BaCl2, NaOH, Al(NH4)(SO4)2- và KHSO4?
A. 1 B. 2
C. 3 D. 4
Lời giải:
- Dùng quỳ tím nhận ra dung dịch NaOH (màu xanh) và dung dịch BaCl2 (màu tím).
- Còn dung dịch KHSO4 và Al(NH4)(SO4)2 đều làm quỳ tím hóa đỏ
+ KHSO4: không có hiện tượng
+ Al(NH4)(SO4)2: có khí mùi khai và kết tủa trắng tan trong kiềm dư.
→ Đáp án D
Câu 26. Để xác định hàm lượng FeCO3 trong quặng xi đe rit, người ta làm như sau: còn 0,6g mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4 trong môi trường H2SO4 loãng. Chuẩn đọ dung dịch thu được bằng dung dịch chuẩn KMnO4 0,025M thì dùng vừa hết 25,2ml. % theo khối lượng của FeCO3 là:
A. 12,18% B. 24,26%
C. 60,9% D. 30,45%
Lời giải:
nKMnO4 = (0,025.25,2)/1000 = 6,3.10-4 mol
Phương trình phản ứng:
10FeSO4 (3,15.10-3) + 8H2SO4 + 2KMnO4 (6,3.10-4) → 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
mFeCO3 = 3,15.10-3. 116 = 0,3654g
%FeCO3 = (0,3654/0,6). 100% = 60,9%
→ Đáp án C
Câu 27. Trong nước tự nhiên thường có lẫn những lượng nhỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2 và Mg(HCO3)2. Có thể dùng một hóa chất nào sau đây để loại được tất cả các muối trên?
A. NaOH B. Na2CO3
C. NaHCO3 D. K2SO4
Lời giải:
Khi cho Na2CO3 vào loại nước trên thì sẽ tạo kết tủa trắng CaCO3 và MgCO3
→ Đáp án B
Câu 28. Có 3 khí SO2, CO2, H2S. Chỉ dùng một hóa chất nào sau đây để phân biệt được cả 3 khí trên?
A. Dung dịch Ca(OH)2.
B. Dung dịch Ba(OH)2.
C. Dung dịch Br2
D. Dung dịch HCl.
Lời giải:
SO2 (nâu) + Br2 + 2H2O → 2HBr (không màu) + H2SO4
H2S + Br2 → 2HBr + S↑ (vàng)
→ Đáp án C
Câu 29. Cho các kim loại: Ba, Mg, Fe, Al và Ag. Nếu chỉ dùng H2SO4 loãng, có thể nhận biết được những kim loại nào ở trên?
A. Ba, Mg
B. Fe, Al
C. Al, Ag
D. Cả 5 kim loại
Lời giải:
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 loãng lần lượt vào các mẩu thử.
- Kim loại không tan là Ag, các kim loại còn lại tan và tạo khí H2 và các dung dịch muối.
- Trường hợp tạo kết tủa là Ba. Lọc bỏ kết tủa rồi lấy dung dịch nước lọc có chứa Ba(OH)2 cho tác dụng với các dung dịch muối ở trên.
+ Dung dịch tạo kết tủa trắng xanh rồi hóa nâu là FeSO4.
⇒ kim loại ban đầu là Fe.
FeSO4 + Ba(OH)2 → BaSO4 + Fe(OH)2
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
+ Dung dịch tạo kết tủa keo trắng rồi tan dần là Al2(SO4)3 ⇒ kim loại ban đầu là Al.
Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4 + 2Al(OH)3
2Al(OH)3 + Ba(OH)2 → Ba[Al(OH)4]2
+ Dung dịch tạo kết tủa trắng là MgSO4 ⇒ kim loại ban đầu là Mg.
MgSO4 + Ba(OH)2 → BaSO4 + Mg(OH)2
→ Đáp án D
Câu 30. Có 5 bình mất nhãn, chứa riêng biệt các khí SO2, SO3, N2, CH3NH2 và NH3. Nếu chỉ dùng quỳ tím ẩm thì có thể nhận ra bình chứa khí:
A. SO2 B. SO3
C. N2 D. NH3
Lời giải:
SO2 và SO3 làm quỳ tím ẩm hóa đỏ.
CH3NH2 và NH3 làm quỳ tím hóa xanh.
N2 không làm đổi màu quỳ tím.
→ Đáp án C
Câu 31. Lấy 25ml dung dịch A gồm FeSO4 và Fe2(SO4)3 rồi chuẩn độ bằng dung dịch hỗn hợp KMnO4 0,025M thì hết 18,10ml. Mặt khác, thêm lượng dư dung dịch NH3 vào 25ml dung dịch A thì thu được kết tủa, lọc kết tủa rồi nung đỏ trong không khí ở nhiệt độ cao đến khối lượng không đổi, cân được 1,2g. Nồng độ mol/l của FeSO4 và Fe2(SO4)3 lần lượt là:
A. 0,091 và 0,25 B. 0,091 và 0,265
C. 0,091 và 0,255 D. 0,087 và 0,255
Lời giải:
Ta có:
nFeSO4 = 5.nKMnO4 = 2,2615.10-3 mol
CM FeSO4 = 2,2625/0,025 = 0,091M
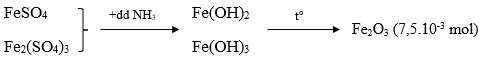
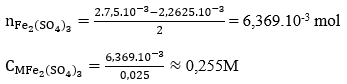
→ Đáp án C
Câu 32. Chuẩn độ 20 ml dung dịch HCl chưa biết nồng độ đã dùng hết 17 ml dung dịch NaOH 0,12M. Xác định nồng độ mol của dung dịch HCl.
A. 0,102M B. 0,12M
C. 0.08M D. 0,112M
Lời giải:
PTHH: HCl + NaOH → NaCl + H2O
nNaOH = 0,017. 0,12 = 0,00204(mol)
Theo PT: nHCl = nNaOH = 0,00204 mol
Nồng độ mol của dung dịch HCl là: 0,00204/0,02 = 0,102(M)
→ Đáp án A
Câu 33. Để tách riêng ion Zn2+, Cu2+, Fe2+ ra khỏi hỗn hợp thì có thể dùng các hóa chất nào sau đây?
A. Các dung dịch KOH, NH3, H2SO4.
B. Các dung dịch NH3, H2SO4, HCl.
C. Các dung dịch H2SO4, KOH, BaCl2.
D. Các dung dịch H2SO4, NH3, HNO3.
Lời giải:
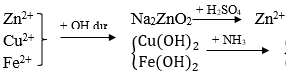
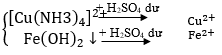
→ Đáp án A
Câu 34. Có dung dịch hỗn hợp chứa các ion Fe3+, Al3+, Cu2+. Dùng những dung dịch nào sau đây có thể tách riêng từng ion ra khỏi hỗn hợp?
A. Dung dịch NaOH, NH3.
B. Dung dịch NaOH, NH3, HCl
C. Dung dịch NaOH, HCl, H2SO4
D. Dung dịch Ba(OH)2, NaOH, NH3.
Lời giải:
Tách các chất theo sơ đồ sau:
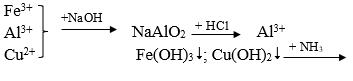
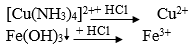
→ Đáp án B
Câu 35. Có 5 dung dịch mất nhãn gồm CuCl2, NaNO3, Mg(NO3)2; NH4NO3 và Fe(NO3)3. Có thể dùng kim loại nào sau đây để phân biệt cả 5 dung dịch?
A. Na B. Fe
C. Cu D. Ag
Lời giải:
Dùng Na: Na + H2O → NaOH + 1/2 H2
Sau đó: CuCl2 + 2NaOH → Cu(OH)2↓ (xanh) + 2NaCl
Mg(NO3)2 + 2NaOH → Mg(OH)2↓ (trắng) + 2NaNO3
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
Fe(NO3)3 + 3NaOH → Fe(OH)3↓ (nâu đỏ) + 3NaNO3
→ Đáp án A
Câu 36. Có 6 lọ hóa chất bị mất nhãn đựng riêng biệt sáu dung dịch Na2CO3, NH4Cl, MgCl2, AlCl3, FeSO4 và Fe2(SO4)3. Bằng phương pháp hóa học và chỉ dùng một thuốc thử nào sau đây có thể nhận biết được cả sáu lọ hóa chất trên?
A. Dung dịch HCl B. Dung dịch NH3
C. Dung dịch NaOH D. Dung dịch H2SO4
Lời giải:
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch NaOH lần lượt vào các mẩu thử.
- NH4Cl: tạo khí mùi khai NH3
- MgCl2: tạo kết tủa trắng Mg(OH)2
- AlCl3: tạo kết tủa keo trắng Al(OH)3 tan trong kiềm dư
- FeSO4: tạo kết tủa trắng xanh Fe(OH)2 bị hóa nâu trong không khí
- Fe2(SO4)3: tạo kết tủa nâu đỏ Fe(OH)3
→ Đáp án C
Câu 37. Khí CO2 có lẫn tạp chất là khí HCl. Để loại tạp chất HCl đó nên cho khí CO2 đi qua dung dịch nào sau đây là tốt nhất?
A. Dung dịch NaOH dư.
B. Dung dịch Na2CO3 dư.
C. Dung dịch NaHCO3 dư.
D. Dung dịch AgNO3 dư.
Lời giải:
Vì NaHCO3 vừa loại được HCl lại tạo ra được một lượng CO2 mới.
NaHCO3 + HCl → NaCl + CO2↑ + H2O
→ Đáp án C
Câu 38. Cho năm lọ mất nhãn đựng các dung dịch: KNO3, Cu(NO3)2, FeCl3 và NH4Cl. Có thể dùng hóa chất nào sau đây để nhận biết chúng?
A. Dung dịch NaOH dư
B. Dung dịch AgNO3
C. Dung dịch Na2SO4
D. Dung dịch HCl
Lời giải:
Trích mẩu thử cho mỗi lần thí nghiệm.
Cho dung dịch NaOH lần lượt vào các mẩu thử.
- Mẩu thử tạo kết tủa xanh là Cu(NO3)2.
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
- Mẩu thử tạo kết tủa nâu đỏ là FeCl3.
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
- Mẩu thử tạo kết tủa keo trắng tan trong kiềm dư là AlC13.
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → Na[Al(OH)4]
- Mẩu thử có khí mùi bay ra là NH4Cl.
NH4Cl + NaOH → NaCl + NH3 + H2O
→ Đáp án A
Câu 39. Cho ba hợp kim: Cu-Ag, Cu-Al, Cu-Zn. Thuốc thử nào sau đây có thể được dùng để phân biệt ba hợp kim trên?
A. HCl và NaOH
B. HNO3 và NH3
C. H2SO4 và NaOH
D. H2SO4 loãng và NH3
Lời giải:
Trích mẩu thử cho mỗi lần thí nghiệm. Cho dung dịch H2SO4 lần lượt vào các mẩu thử.
- Hợp kim nào không có khí là Cu-Ag.
- Cho dung dịch NH3 vào dung dịch thu được trong hai trường hợp còn lại.
+ Trường hợp tạo kết tủa keo trắng và không tan trong NH3 dư ⇒ hợp kim là Cu-Al.
3Al + 3H2SO4 → Al2(SO4)3 + 3H2
Al2(SO4)3 + 6NH3 + 6H2O → 2Al(OH)3 + 3(NH4)2SO4
+ Trường hợp tạo kết tủa rồi tan trong NH3 dư ⇒ hợp kim ban đầu là Cu-Zn.
Zn + H2SO4 → ZnSO4 + H2
ZnSO4 + 2NH3 + 2H2O → Zn(OH)2 + (NH4)2SO4
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
→ Đáp án D
Câu 40. Để phân biệt hai khí SO2 và H2S thì nên sử dụng thuốc thử nào dưới đây?
A. Dung dịch KMnO4
B. Dung dịch Br2
C. Dung dịch CuCl2
D. Dung dịch NaOH
Lời giải:
H2S tạo kết tủa đen với CuCl2.
H2S + CuCl2 → CuS + 2HCl
→ Đáp án C
Thi online Hóa 12 KNTTThi online Hóa 12 CDThi online Hóa 12 CTST
Xem thêm các dạng bài tập Hóa học lớp 12 ôn thi Tốt nghiệp có lời giải hay khác:
- Dạng 1: Các dạng bài tập về nhận biết, tách chất
- Dạng 2: Các bài toán về chuẩn độ axit bazo, chuẩn độ oxi hoa khử
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (cơ bản – phần 1)
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (cơ bản – phần 2)
- 40 câu trắc nghiệm Phân biệt một số chất vô cơ có lời giải (nâng cao – phần 1)
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

