Mạ điện là gì (chi tiết nhất)
Bài viết Mạ điện là gì lớp 12 chi tiết nhất là kiến thức có trong chương trình Hóa học 12 giúp học sinh nắm vững kiến thức trọng tâm về Mạ điện.
Mạ điện là gì (chi tiết nhất)
1. Mạ điện là gì?
- Phương pháp điện phân được sử dụng trong mạ điện, trong đó ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
2. Kiến thức mở rộng Mạ điện là gì
2.1. Khái niệm
- Điện phân là một quá trình oxi hoá - khử xảy ra tại các điện cực khi có dòng điện một chiều với hiệu điện thế đủ lớn đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
- Phản ứng oxi hoá - khử xảy ra trong quá trình điện phân là phản ứng không tự xảy ra mà phải nhờ tác động của điện năng để gây ra phản ứng đó.
- Các chất tham gia vào quá trình điện phân có thể ở trạng thái nóng chảy (điện phân nóng chảy) hoặc dung dịch (điện phân dung dịch). Trong quá trình điện phân, dưới tác dụng của điện trường, các ion âm sẽ di chuyển về điện cực dương, các ion dương sẽ di chuyển về điện cực âm.
- Khi điện phân dung dịch, nước cũng có thể tham gia điện phân với vai trò chất khử (2H2O → O2 + 4H+ + 4e) hoặc chất oxi hoá (2H2O + 2e → H2 + 2OH-).
- Theo quy ước chung, đối với cả pin điện và bình điện phân, tại cathode xảy ra quá trình khử và tại anode xảy ra quá trình oxi hoá. Do vậy, trong điện phân cathode là cực âm, anode là cực dương.
- Ví dụ: Sodium chloride (NaCl) nóng chảy điện li thành các ion Na+ và Cl− chuyển động tự do. Trong điện trường, các ion sẽ di chuyển về các cực trái dấu. Ở một hiệu điện thế đủ lớn, trên bề mặt các điện cực xảy ra các quá trình:
|
Cực âm (cathode) |
Quá trình khử ion Na+ |
Na+ + 1e → Na |
|
Cực dương (anode) |
Quá trình oxi hoá ion Cl− |
Phương trình hoá học của phản ứng điện phân NaCl nóng chảy:
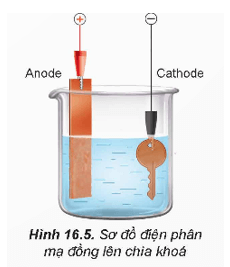
2.2. Nguyên tắc mạ điện
- Trong kĩ thuật mạ điện, các kim loại mạ thường là chromium, nickel, đồng, vàng, bạc, platinum, ...
- Bình mạ điện chứa dung dịch muối của kim loại mạ, vật cần mạ và thanh kim loại mạ.
- Vật cần mạ được nối với cathode. Kim loại mạ được nối với anode. Khi đó kim loại mạ ở anode sẽ tan vào dung dịch (hiện tượng dương cực tan), sau đó bám lên vật cần mạ.
3. Bài tập minh họa Mạ điện là gì
Câu 1. Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình
A. Ag → Ag+ + 1e.
B. Fe → Fe2+ + 2e.
C. 2H2O → 4H+ + O2 + 4e.
D. C → C4+ + 4e.
Hướng dẫn giải
Đáp án đúng là: A
Trong quá trình mạ bạc cho một chiếc vòng bằng thép thì ở anode xảy ra quá trình:
Ag → Ag+ + 1e.
Câu 2. Để mạ 5,0 g bạc lên một đĩa sắt khi điện phân dung dịch chứa với dòng điện có cường độ 1,5 A không đổi cần thời gian t phút.
Cho biết:
- Quá trình khử tại cathode: + 1e → Ag + 2NH3.
- Điện lượng q = It = ne. F với F = 96 500 C/mol.
Giá trị của t là
A. 44,68.
B. 49,6.
C. 36.
D. 46,98.
Hướng dẫn giải
Đáp án đúng là: B
Số mol electron: ne = 1. nAg = 0,0463 mol
Điện lượng q = ne . F = 4468 C
phút
Câu 3. Cho các phát biểu về cách mạ một huy chương bạc
a. Dùng huy chương làm cathode.
b. Dùng muối AgNO3 làm dung dịch điện ly.
c. Dùng anode bằng bạc.
d. Đặt huy chương ở giữa hai điện cực anode và cathode.
Phát biểu đúng là
A. a, b, c.
B. a, b, d.
C. a, c, d.
D. a, d.
Hướng dẫn giải
Đáp án đúng là: A
Để mạ bạc cho huy chương ta phải dùng huy chương làm cathode, anode phải bằng bạc và dung dịch phải chứa muối của kim loại bạc có thể là AgNO3.
a. Đúng.
b. Đúng.
c. Đúng.
d. Sai vì huy chương nối với cathode.
Câu 4. Phát biểu nào sau đây về điện phân là đúng?
A. Trong quá trình điện phân dung dịch, khối lượng dung dịch luôn giảm.
B. Trong quá trình điện phân dung dịch, anode luôn xảy ra quá trình khử.
C. Trong quá trình điện phân dung dịch NaCl (điện cực trơ, có màng ngăn), pH của dung dịch tăng.
D. Trong quá trình điện phân dung dịch, cathode luôn thu được kim loại.
Hướng dẫn giải
Đáp án đúng là: C
A. Sai vì trong quá trình điện phân khi tinh luyện và điều chế kim loại, thường sẽ tách kim loại từ vật liệu cần tinh chế sang điện cực chỉ chứa kim loại đó, khối lượng dung dịch sẽ không đổi.
B. Sai vì ở cathode luôn xảy ra quá trình khử.
C. Đúng vì xảy ra phản ứng: 2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g).
D. Sai vì một số ion kim loại như: Na+, K+,.. không bị khử khi điện phân dung dịch muối của chúng nên không thu được kim loại.
Câu 5. Trong quá trình điện phân, 1 mol Cu2+ được điện phân cần bao nhiêu mol electron?
A. 3.
B. 2.
C. 1.
D. 6.
Hướng dẫn giải
Đáp án đúng là: B
Trong quá trình điện phân, Cu2+ bị khử thành Cu: Cu2++ 2e → Cu.
Như vậy 1 mol Cu2+ được điện phân cần 2 mol electron.
Câu 6. Muốn mạ bạc cho một chiếc nhẫn đồng thì cực dương được nối với
A. chiếc nhẫn.
B. bạc nguyên chất.
C. đồng nguyên chất.
D. đồng thau.
Hướng dẫn giải
Đáp án đúng là: B
Muốn mạ bạc cho một chiếc nhẫn đồng thì cực dương được nối với bạc, cực âm nối với chiếc nhẫn. Khi đó bạc sẽ tan vào dung dịch và bám lên nhẫn.
Câu 7. Muốn mạ đồng (Cu) lên vật làm từ sắt (Fe) cần sử dụng phương pháp điện phân với anode làm bằng đồng và cathode là vật bằng sắt cần được mạ và cùng nhúng vào dung dịch
A. muối đồng.
B. muối sắt.
C. muối nhôm.
D. muối kẽm.
Hướng dẫn giải
Đáp án đúng là: A
Muốn mạ đồng (Cu) lên vật làm từ sắt (Fe) cần sử dụng phương pháp điện phân với anode làm bằng đồng và cathode là vật bằng sắt cần được mạ và cùng nhúng vào dung dịch muối đồng ví dụ như CuSO4.
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

