Muối ammonium là gì (chi tiết nhất)
Bài viết Muối ammonium là gì lớp 11 chi tiết nhất là kiến thức có trong chương trình Hóa học 11 giúp học sinh nắm vững kiến thức trọng tâm về Muối ammonium.
Muối ammonium là gì (chi tiết nhất)
1. Muối ammonium là gì?
Muối ammonium là tinh thể ion gồm cation NH4+ và anion gốc acid
Một số muối ammonium phổ biến: NH4Cl, NH4ClO4, NH4NO3, (NH4)2SO4, NH4H2PO4, (NH4)2HPO4, NH4HCO3, (NH4)2Cr2O7.
2. Kiến thức mở rộng
2.1. Tính tan, sự điện li
Hầu hết các muối ammonia đều tan trong nước và phân li hoàn toàn ra ion.
Ví dụ:
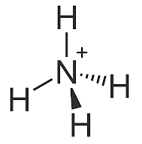
Chú ý: Dạng hình học của ion ammonium:
2.2. Tác dụng với kiềm – Nhận biết ion ammonium
Khi đun nóng hỗn hợp muối ammonium với dung dịch kiềm, sinh ra khí ammonia có mùi khai.
Ví dụ:
(NH4)2SO4 + 2NaOH Na2SO4 + 2NH3 + 2H2O
Phương trình ion rút gọn:
2.3. Tính chất
Các muối ammonium đều kém bền nhiệt và dễ bị phân huỷ khi đun nóng.
Ví dụ:
NH4Cl NH3 + HCl
NH4HCO3 NH3 + CO2 + H2O
NH4NO3 N2O + 2H2O
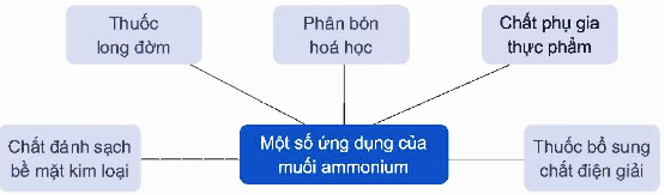
2.4. Ứng dụng
Một số ứng dụng của muối ammonium được thể hiện ở sơ đồ sau:
3. Bài tập minh họa
Câu 1: Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó là
A. NH3.
B. H2.
C. NO2
D. NO.
Hướng dẫn giải
Đáp án đúng là: A
Có thể nhận biết muối ammonium bằng cách cho muối tác dụng với dung dịch kiềm thấy thoát ra một chất khí. Chất khí đó làNH3.
Ví dụ: NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O
Câu 2:Phát biểu nào sau đây không đúng?
A. Các muối ammonium đều dễ tan trong nước.
B. Các muối ammonium khi tan trong nước đều phân li hoàn toàn thành ion.
C. Dưới tác dụng của nhiệt, muối ammonium đều bị phân hủy thành ammonia và acid.
D. Có thể dùng muối ammonium để đều chế NH3 trong phòng thí nghiệm.
Hướng dẫn giải
Đáp án đúng là: C
C sai vì
Câu 3: Phát biểu nào sau đây không đúng?
A. Muối ammonium dễ tan trong nước.
B. Muối ammonium là chất điện li mạnh.
C. Muối ammonium kém bền với nhiệt.
D. Dung dịch muối ammonium có tính chất base.
Hướng dẫn giải
Đáp án đúng là: D
Dung dịch muối ammonium có tính chất acid.
Câu 4: Dãy các muối ammonium nào khi bị nhiệt phân tạo thành khí NH3?
A. NH4Cl, NH4HCO3, (NH4)2CO3.
B. NH4Cl, NH4NO3, NH4HCO3.
C. NH4Cl, NH4NO3, (NH4)2CO3.
D. NH4NO3, NH4HCO3, (NH4)2CO3.
Hướng dẫn giải
Đáp án đúng là: A
A đúng vì
B, C, D sai vì
Câu 5: Xác định các chất X, Y trong sơ đồ sau:
A. HCl, HNO3.
B. BaCl2, AgNO3.
C. CaCl2, HNO3.
D. HCl, AgNO3.
Hướng dẫn giải
Đáp án đúng là: B
(NH4)2SO4 + BaCl2 → 2NH4Cl + BaSO4↓
NH4Cl + AgNO3 → NH4NO3 + AgCl↓
Câu 6: Thuốc thử duy nhất để nhận biết 4 dung dịch đựng trong 4 lọ mất nhãn là KOH, NH4Cl K2SO4, (NH4)2SO4 là
A. dung dịch AgNO3
B. dung dịch BaCl2.
C. dung dịch NaOH.
D. dung dịch Ba(OH)2.
Hướng dẫn giải
Đáp án đúng là: D
Dùng dung dịch Ba(OH)2 nhận biết 4 dung dịch đựng trong 4 lọ mất nhãn là KOH, NH4Cl K2SO4, (NH4)2SO4:
- Dung dịch NH4Cl có khí mùi khai thoát ra:
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + 2H2O
- Dung dịch K2SO4 có kết tủa trắng tạo thành:
K2SO4 + BaCl2 → 2KCl + BaSO4↓
- Dung dịch (NH4)2SO4 vừa có khí mùi khai thoát ra và có kết tủa trắng tạo thành
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O
- Dung dịch KOH không phản ứng.
Câu 7: Nhiệt phân hoàn toàn muối nào sau đây thu được sản phẩm chỉ gồm khí và hơi?
A. NaCl.
B. CaCO3.
C. KClO3,
D. (NH4)2CO3.
Hướng dẫn giải
Đáp án đúng là: D
Muối bị nhiệt phân hoàn toàn thu được sản phẩm chỉ gồm khí và hơi là (NH4)2CO3
(NH4)2CO3 2NH3 + CO2 + H2O
Câu 8:Phân biệt được đung dịch NH4Cl và NaCl bằng thuốc thử là dung dịch
A. KCl.
B. KNO3.
C. KOH.
D. K2SO4.
Lời giải:
Đáp án đúng là: C
Phân biệt được đung dịch NH4Cl và NaCl bằng thuốc thử là dung dịch KOH.
Hiện tượng: Thêm KOH vào dung dịch NH4Cl thấy xuất hiện khí mùi khai, còn thêm vào dung dịch NaCl không thấy hiện tượng gì.
NH4Cl + KOH → KCl + NH3↑ + H2O
Khí mùi khai là NH3.
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều

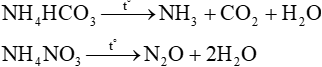
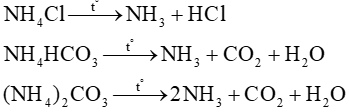



 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

