Năng lượng liên kết là gì (chi tiết nhất)
Bài viết Năng lượng liên kết là gì lớp 10 chi tiết nhất là kiến thức có trong chương trình Hóa học 10 giúp học sinh nắm vững kiến thức trọng tâm về Năng lượng liên kết.
Năng lượng liên kết là gì (chi tiết nhất)
1. Năng lượng liên kết là gì?
- Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí. Đơn vị của năng lượng liên kết thường là kJ mol-1.
Ví dụ: Để phá vỡ liên kết H – H trong 1 mol khí H2 ở 25oC và 1 bar cần năng lượng là 436 kJ.
2. Kiến thức mở rộng
Ý nghĩa của ngăng lượng liên kết:
- Năng lượng liên kết đặc trưng cho độ bền của liên kết. Năng lượng liên kết càng lớn, liên kết đó càng bền.
Ví dụ: Năng lượng liên kết của H – H là 436 kJ mol-1, của H – I là 299 kJ mol-1. Như vậy, liên kết H – H bền hơn liên kết H – I.
Chú ý: Dựa vào hiệu giữa năng lượng liên kết của các chất tham gia và tạo thành sau phản ứng có thể biết được phản ứng nào là tỏa nhiệt và phản ứng nào là thu nhiệt.
3. Bài tập minh họa
Câu 1. Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau:
Hydrogen halide |
Năng lượng liên kết (kJ/mol) |
HF |
565 |
HCl |
427 |
HBr |
363 |
HI |
295 |
Các hydrogen halide được sắp xếp theo chiều tăng dần độ bền liên kết là:
A. HI < HBr < HCl < HF
B. HBr < HBr < HI < HF
C. HCl < HI < HBr < HF
D. HF < HBr < HI < Cl
Hướng dẫn giải
Đáp án đúng là: A
Năng lượng liên kết càng lớn thì độ bền liên kết càng cao ⇒ chiều tăng độ bền liên kết: HI, HBr, HCl, HF.
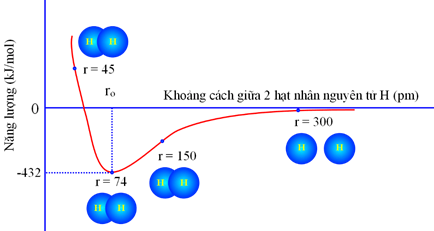
Câu 2. Dưới đây là biểu đồ tương tác của hai nguyên tử hydrogen ở thể khí so với khoảng cách hạt nhân giữa chúng:
Nănglượng liên kết của phân tử hydrogen (H2) và độ dài liên kết H−H lần lượt là
A. 432 kJ/mol và 74 pm.
B. 432 kJ/mol và 150 pm.
C. 0 kJ/mol và 300 pm.
D. 0 kJ/mol và 45 pm.
Hướng dẫn giải
Đáp án đúng là: A
Năng lượng liên kết tối thiểu đại diện cho độ bền liên kết và khoảng cách ro tại mức năng lượng tối thiểu là độ dài liên kết ⇒ Năng lượng liên kết của H2 là 432 kJ/mol và độ dài liên kết H – H là 74 pm.
Câu 3. Cho biết năng lượng liên kết H-H là 436 kJ mol-1. Năng lượng cần thiết (theo eV) để phá vỡ liên kết trong phân tử H2 là (cho biết 1 eV= 1,602x10-19J)
A. 4,36.
B. 1,60.
C. 2,36.
D. 4,52.
Hướng dẫn giải
Đáp án đúng là: D
Năng lượng cần thiết để phá vỡ liên kết trong phân tử H2 là
Câu 4.Cho bảng tương quan giữa độ dài liên kết và năng lượng liên kết:
C – C |
C = C |
C ≡ C |
|
Độ dài liên kết () |
1,54 |
1,34 |
1,20 |
Năng lượng liên kêt (kJ/ mol) |
347 |
614 |
839 |
Nhận xét nào sau đây là đúng?
A. Độ dài liên kết tỉ lệ thuận với năng lượng liên kết
B. Độ dài liên kết không có liên hệ với năng lượng liên kết
C. Độ dài liên kết tỉ lệ thuận với độ bền liên kết
D. Độ dài liên kết tỉ lệ nghịch với năng lượng liên kết
Hướng dẫn giải
Đáp án đúng là: D
Nhận xét mối tương quan giữa độ dài liên kết và năng lượng liên kết: Theo bảng số liệu ta thấy độ dài liên kết giảm dần đồng thời năng lượng liên kết tăng dần ⇒ độ dài liên kết tỉ lệ nghịch với năng lượng liên kết.
Câu 5. Cho biết năng lượng liên kết S – H (368 kJ/mol) ở điều kiện chuẩn (25oC, 1 bar) là 736 kJ/mol. Tổng năng lượng liên kết trong H2S là
A. 143 kJ/mol.
B. 368 kJ/mol.
C. 3680 kJ/mol.
D. 736 kJ/mol.
Hướng dẫn giải
Đáp án đúng là: D
H2S: H – S – H ⇒ Tổng năng lượng liên kết trong H2S: 2.368 = 736 kJ/mol.
Câu 6. Khi phản ứng với H2 các phân tử như F2, N2 cần phải cắt đứt liên kết giữa các nguyên tử. Cho năng lượng liên kết Eb (H – H) = 159 kJ/mol, Eb (N ≡ N) = 946 kJ/mol. Phát biểu nào sau đây là đúng?
A. phản ứng của N2 với H2 sẽ xảy ra dễ hơn.
B. phản ứng của F2 với H2 và phản ứng N2 với H2 đều dễ xảy ra như nhau.
C. phản ứng của F2 với H2 sẽ xảy ra dễ hơn.
D. phản ứng của F2 với H2 và phản ứng N2 với H2 đều khó xảy ra như nhau.
Hướng dẫn giải
Đáp án đúng là: C
Vì năng lượng liên kết của H – H thấp hơn N ≡ N nên liên kết H – H dễ bị phá vỡ hơn ⇒ phản ứng của F2 với H2 sẽ xảy ra dễ hơn.
Câu 7.Cho biết năng lượng liên kết H – I và H – Br lần lượt là 297 kJ mol−1 và 364 kJ mol−1. Phát biểu nào sau đây là không đúng?
A. Khi đun nóng, HI bị phân huỷ (thành H2 và I2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2).
B. Liên kết H − Br là bền vững hơn so với liên kết H − I
C. Khi đun nóng, HI bị phân huỷ (thành H2 và I2) ở nhiệt độ cao hơn so với HBr (thành H2 và Br2)
D. Liên kết H – I ngắn hơn liên kết H – Br.
Hướng dẫn giải
Đáp án đúng là: C
Vì năng lượng liên kết H – I nhỏ hơn năng lượng liên kết H – Br nên HI kém bền hơn HBr. Khi đun nóng, HI bị phân huỷ (thành H2 và I2) ở nhiệt độ thấp hơn so với HBr (thành H2 và Br2)
Câu 8. Cho các phát biểu sau:
(a) Các nguyên tử liên kết với nhau theo xu hướng tạo hệ bền vững hơn.
(b) Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng thấp hơn.
(c) Các nguyên tử liên kết với nhau theo xu hướng tạo lớp vỏ electron thỏa mãn quy tắc octet.
(d) Các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng cao hơn.
(e) Các nguyên tử nguyên tố phi kim chỉ liên kết với các nguyên tử nguyên tố kim loại.
Số phát biểu không đúng là
A. 2.
B. 3.
C. 4.
D. 1.
Hướng dẫn giải
Đáp án đúng là: A
Bao gồm d, e.
(d) sai vì các nguyên tử liên kết với nhau theo xu hướng tạo hệ có năng lượng thấp hơn.
(e) sai vì các nguyên tử của nguyên tố phi kim có thể liên kết với các nguyên tử của nguyên tố kim loại hoặc phi kim.
Xem thêm các bài viết về định nghĩa & khái niệm môn Hóa học hay, chi tiết khác:
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 12 Global Success
- Giải sgk Tiếng Anh 12 Smart World
- Giải sgk Tiếng Anh 12 Friends Global
- Lớp 12 Kết nối tri thức
- Soạn văn 12 (hay nhất) - KNTT
- Soạn văn 12 (ngắn nhất) - KNTT
- Giải sgk Toán 12 - KNTT
- Giải sgk Vật Lí 12 - KNTT
- Giải sgk Hóa học 12 - KNTT
- Giải sgk Sinh học 12 - KNTT
- Giải sgk Lịch Sử 12 - KNTT
- Giải sgk Địa Lí 12 - KNTT
- Giải sgk Giáo dục KTPL 12 - KNTT
- Giải sgk Tin học 12 - KNTT
- Giải sgk Công nghệ 12 - KNTT
- Giải sgk Hoạt động trải nghiệm 12 - KNTT
- Giải sgk Giáo dục quốc phòng 12 - KNTT
- Giải sgk Âm nhạc 12 - KNTT
- Giải sgk Mĩ thuật 12 - KNTT
- Lớp 12 Chân trời sáng tạo
- Soạn văn 12 (hay nhất) - CTST
- Soạn văn 12 (ngắn nhất) - CTST
- Giải sgk Toán 12 - CTST
- Giải sgk Vật Lí 12 - CTST
- Giải sgk Hóa học 12 - CTST
- Giải sgk Sinh học 12 - CTST
- Giải sgk Lịch Sử 12 - CTST
- Giải sgk Địa Lí 12 - CTST
- Giải sgk Giáo dục KTPL 12 - CTST
- Giải sgk Tin học 12 - CTST
- Giải sgk Hoạt động trải nghiệm 12 - CTST
- Giải sgk Âm nhạc 12 - CTST
- Lớp 12 Cánh diều
- Soạn văn 12 Cánh diều (hay nhất)
- Soạn văn 12 Cánh diều (ngắn nhất)
- Giải sgk Toán 12 Cánh diều
- Giải sgk Vật Lí 12 - Cánh diều
- Giải sgk Hóa học 12 - Cánh diều
- Giải sgk Sinh học 12 - Cánh diều
- Giải sgk Lịch Sử 12 - Cánh diều
- Giải sgk Địa Lí 12 - Cánh diều
- Giải sgk Giáo dục KTPL 12 - Cánh diều
- Giải sgk Tin học 12 - Cánh diều
- Giải sgk Công nghệ 12 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 12 - Cánh diều
- Giải sgk Giáo dục quốc phòng 12 - Cánh diều
- Giải sgk Âm nhạc 12 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

