Bài tập Kim loại tác dụng với dung dịch muối cực hay, có đáp án
Bài viết Kim loại tác dụng với dung dịch muối với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Kim loại tác dụng với dung dịch muối.
Bài tập Kim loại tác dụng với dung dịch muối cực hay, có đáp án
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Bài 1: Cho thanh kim loại A (hóa trị 2) vào dung dịch Cu(NO3)2 thì sau phản ứng khối lượng thanh giảm 0,2%. Cũng thanh kim loại trên nếu cho vào dung dịch Pb(NO3)2 thì khối lượng lại tăng 28,4%. Xác định kim loại A.
A. Zn B. Fe C. Cu D. Mg
Bài 2: Ngâm một đinh sắt trong 200 ml dung dịch CuSO4 x M. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 1,6gam. Giá trị của x là
A. 0,5 M B. 0,75 M C. 1 M D. 1,5 M
Bài 3: Ngâm một thanh kim loại bằng đồng có khối lượng 10gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra khỏi dd thì khối lượng AgNO3 trong dung dịch giảm 17%. Khối lựợng của thanh kim loại sau phản ứng là?
A. 10,76 g B. 10,67 g C. 9,67 g D. 9,76 g
Bài 4: Một thanh kim loại M hóa trị II nhúng vào 1 lít dd CuSO4 0,5M sau khi lấy thanh M ra khỏi dd thấy khối lượng tăng 1,6g, nồng độ CuSO4 gỉam còn 0,3M. Kim loại M là?
A. Cu B. Fe C. Ag D. Zn
Bài 5: Nhúng một lá kẽm vào dung dịch CuSO4 sau một thời gian lấy lá kẽm ra cân thấy nhẹ hơn 0,025g so với trước khi nhúng. Khối lượng Zn đã tan ra.
A. 1,256g B. 1,265g C. 1,652g D. 1,625g
Bài 6: Cho một thanh sắt nặng 20 gam vào 200ml dung dịch CuSO4 0,5M. Khi phản ứng xảy ra xong thì khối lượng thanh sắt sau khi đem ra khỏi dung dịch và sấy khô là?
A. 20,8 g B. 20,9 g C. 20,7 g D. 20,6 g
Bài 7: Một hỗn hợp 4,15g chứa Fe và Al tác dụng với 200ml dung dịch CuSO4 0,525M. Khuấy kỹ để phản ứng xảy ra hoàn toàn. Thu được kết tủa gồm hai kim loại có khối lượng 7,48g. Tìm số mol các kim loại trong hỗn hợp ban đầu.
A. 0,25 mol và 0,75 mol B. 0,75 mol và 0,25 mol
C. 0,5 mol và 0,5 mol D. Đáp án khác
Bài 8: Ngâm một lá đồng trong 20ml dung dịch silver nitrate cho đến khi đồng không thể tan thêm được nữa. Lấy lá đồng ra, rửa nhẹ, làm khô và cân thì khối lượng lá đồng tăng thêm 1,52g. Hãy xác định nồng độ mol của dung dịch silver nitrate đã dùng (giả thiết toàn bộ bạc giải phóng ra bám hết vào lá đồng).
A. 0,75 M B. 0,5 M C. 1 M D. 0,25 M
Bài 9: Ngâm một lá sắt trong 100ml dung dịch đồng nitrate cho đến khi sắt không thể tan thêm được nữa. Lấy lá sắt ra, rửa nhẹ, làm khô và cân thì khối lượng lá sắt tăng thêm 1,6g. Hãy xác định nồng độ mol của dung dịch đồng nitrate đã dùng (giả thiết toàn bộ đồng giải phóng ra bám hết vào lá sắt).
A. 1 M B. 0,5 M C. 1,5 M D. 2 M
Bài 10: Ngâm một lá sắt có khối lượng 2,5g trong 25ml dung dịch CuSO4 15% có khối lượng riêng là 1,12g/ml. Sau thời gian phản ứng, người ta lấy lá sắt ra rửa nhẹ, làm khô thì cân nặng 2,56g. Tính nồng độ phần trăm của FeSO4 và CuSO4 trong dung dịch sau phản ứng.
A. 4,08% và 10,74% B. 10,745% và 4,08%
C. 4% và 10,754% D. 10,754% và 4%
Đáp án và hướng dẫn giải
| 1. A | 2. C | 3. A | 4. B | 5. D |
| 6. A | 7. C | 8. C | 9. D | 10. A |
Bài 1:
Cho thanh kim loại A(Hóa trị 2) vào dung dịch Cu(NO3)2 thấy khối lượng thanh kim loại giảm đi ⇒ MA > MCu ⇔ MA > 64.
Cho thanh kim loại A(Hóa trị 2) vào dung dịch Pb(NO3)2 thấy khối lượng thanh kim loại tăng lên ⇒ MA < MPb ⇔ MA < 127 .
⇒ Chọn A.
Bài 2:
nCuSO4 = x.0,2 mol
Fe + CuSO4 → FeSO4 + Cu
x.0,2 x.0,2 x.0,2 (mol)
Khi nhúng thanh Fe vào dung dịch CuSO4, thanh Fe lúc sau có khối lượng tăng lên 1,6 gam là:
mCu bám vào - mFe tan = 1,6 g
⇔ 0,2x.64 - 0,2x.56 = 1,6

⇒ Chọn C.
Bài 3:
mAgNO3 = 4/100.250 = 10g
⇒ mAgNO3 pư = 10/200.17 = 1,7g
⇒ nAgNO3 pư = 0,01 mol
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
⇒ nCu pư = 1/2 nAgNO3(pư) = 0,005 mol
⇒ nAg = nAgNO3=0,01 mol
⇒ mthanh KL = mCu(bđ) - mCu (pư) +mAg = 10-0,005.64+0,01.108 = 10,76g
⇒ Chọn A.
Bài 4:
nCuSO4 (bđ) = 0,5.1 = 0,5 mol
nCuSO4 (sau pư) = 0,3.1 = 0,3 mol
⇒ nCuSO4 (pư) = 0,5-0,3 = 0,2 mol
M + CuSO4 → MSO4 + Cu
⇒ nCuSO4 (pư) = nM = nMSO4 = nCu = 0,2 mol
mKL(sau) = mKL(bđ) - mM + mCu
⇒ mKL(sau) - mKL(bđ) = mCu - mM
⇒ 1,6 = 0,2.64 - 0,2.MM
⇒ MM = 56
Vậy M là Fe.
⇒ Chọn B.
Bài 5:
Zn → Cu
1 1 → mgiam = 65-64=1g
x x → mgiam = 0,025 g
⇒ x = 0,025/1 = 0,025 mol
⇒ mZn tan = 0,025.65=1,625g
⇒ Chọn D.
Bài 6:
nCuSO4 = 0,5.0,2 = 0,1 mol
nFe = 20/56 ≈ 0,357 mol
Vì nFe > nCuSO4 nên CuSO4 phản ứng hết.
Fe + CuSO4 → FeSO4 + Cu
⇒ nCuSO4 = nFe(pư) = nCu(sp) = 0,1 mol
⇒ mthanh Kl sau = mthanh Kl bđ - mFe + mCu = 20-0,1.56+0,1.64 = 20,8g
⇒ Chọn A.
Bài 7:
nCuSO4 = 0,525.0,2=0,105 mol
Vì thu được kết tủa là 2 kim loại nên Fe còn dư.
Suy ra, kết tủa là Fe dư và Cu, CuSO4 phản ứng hết.
Gọi a, b, c là số mol của Al phản ứng, Fe phản ứng và Fe dư.
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Fe + CuSO4 → FeSO4 + Cu
Từ phương trình phản ứng và dữ kiện đề bài cho, ta lập được hệ phương trình:

Bài 8:
Cu → 2Ag
1 2 → mtang = 2.108-64 = 152g
x 2x → mtang = =1,52g
⇒ x = 1,52/152 = 0,01 mol
⇒ nAgNO3 = nAg = 2x = 0,02 mol
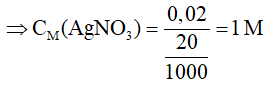
⇒ Chọn C.
Bài 9: Tương tự bài 8.
Chọn D.
Bài 10:
Fe + CuSO4 → FeSO4 + Cu
mdd CuSO4 = 1,12.25 = 28g
⇒ mCuSO4(bđ) = 15/100.28 = 4,2g
⇒ nCuSO4 (bđ) = 4,2/160 = 0,02625 mol
Gọi số mol Fe phản ứng là x mol.
⇒ nFe pư = nCuSO4 pư = nFeSO4 sp = nCu sp = x mol
Ta có:
mla sat (sau) = mla sat (truoc) - mFe + mCu
⇒ 2,56 = 2,5 - 56x + 54x
⇒ 8x = 0,06
⇒ x = 0,0075 mol

Vậy
mdd sau = mdd truoc + mFe pư - mCu sp
mdd sau = 28 + 0,0075.56 -0,0075.64 = 27,94g

⇒ Chọn A.
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm các dạng bài tập Hóa học lớp 9 có đáp án, hay khác:
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

