Bài viết Cách giải bài tập Hỗn hợp kim loại tác dụng với axit với phương pháp giải chi tiết giúp học sinh ôn tập, biết cách làm bài tập Hỗn hợp kim loại tác dụng với axit.
Cách giải bài tập Hỗn hợp kim loại tác dụng với axit (hay, chi tiết)
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Lý thuyết và Phương pháp giải
Dãy hoạt động kim loại
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
Khi Nào May Áo Záp Sắt Phải Hỏi Cúc Bạc Vàng
Dãy được sắp xếp theo chiều giảm dần tính hoạt động hoá học (từ trái sang phải).
- Một số kim loại vừa tác dụng được với axit và với nước: K, Na, Ba, Ca.
Kim loại + H2O → Dung dịch bazơ + H2
- Kim loại vừa tác dụng với axit, vừa tác dụng với bazơ: (Be), Al, Zn, Cr
2A + 2(4 – n)NaOH + 2(n – 2)H2O → 2Na4 –nAO2 + nH2
Ví dụ: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
- Kim loại đứng trước H tác dụng với dung dịch axit HCl, H2SO4 loãng tạo muối và giải phóng H2.
Kim loại + Axit → Muối + H2
Lưu ý:
- Kim loại trong muối có hoá trị thấp (đối với kim loại đa hoá trị).
- Trừ Au và Pt, các kim loại khác đều có thể tác dụng với HNO3 và H2SO4 đặc, nóng nhưng không giải phóng Hidro.
Phương pháp giải:
- B1: Viết PTHH.
- B2: Xử lí số liệu theo dữ kiện đề bài, đặt ẩn số, lập hệ (nếu cần).
- B3: Tính số mol chất cần tìm theo PTHH và hệ PT.
- B4: Tính toán theo yêu cầu của bài toán.
Bài tập vận dụng
Bài 1: Cho 3,79g hỗn hợp hai kim loại là Zn và Al tác dụng với dung dịch H2SO4 loãng dư, thu được 1792 ml khí (đktc). Tính khối lượng từng kim loại trong hỗn hợp.
Lời giải:
Zn + H2SO4 → ZnSO4 + H2 (1)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2 (2)
Số mol khí H2 thu được:
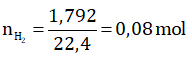
Gọi a và b lần lượt là số mol Zn và Al trong hỗn hợp.
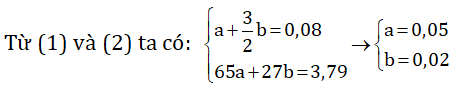
Khối lượng Zn: 65.0,05 = 3,25 g
Khối lượng Al: 27.0,02 = 0,54 gam
Bài 2: Hỗn hợp 3 kim loại Fe, Al, Cu nặng 17,4 gam. Nếu hòa tan hỗn hợp bằng axit H2SO4 loãng dư thì thoát ra 8,96 dm3 H2 (ở đktc). Còn nếu hòa tan hỗn hợp bằng axit đặc nóng, dư thì thoát ra 12,32 lít SO2 (ở đktc). Tính khối lượng mỗi kim loại ban đầu.
Lời giải:
- Cu không tan trong H2SO4 loãng, chỉ có Fe và Al tan được trong axit loãng
Fe + H2SO4 → FeSO4 + H2↑
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
- H2SO4 đặc nóng hòa tan cả 3 kim loại:
2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2↑ + 6H2O
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
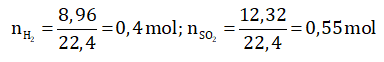
- Gọi số mol của Fe, Al, Cu lần lượt là x, y, z ta có hệ phương trình :
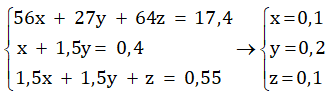
Khối lượng của sắt ban đầu là : mFe = 0,1. 56 = 5,6 (gam)
Khối lượng của nhôm ban đầu là : mAl = 0,2. 27 = 5,4 (gam)
Khối lượng của đồng ban đầu là : mCu = 0,1. 64 = 6,4 (gam)
Bài 3: Cho H2SO4 loãng, dư tác dụng với hỗn hợp gồm Mg và Fe thu được 2,016 lít khí ở đktc. Nếu hỗn hợp kim loại này tác dụng với dd FeSO4 dư thì khối lượng hỗn hợp trên tăng lên 1,68 gam.
a) Viết phương trình phản ứng hóa học.
b) Tìm khối lượng mỗi kim loại trong hỗn hợp trên.
Lời giải:
a) Ta có PTHH:
Mg + H2SO4 → MgSO4 + H2↑ (1)
x mol x mol x mol
Fe + H2SO4 → FeSO4 + H2↑ (2)
y mol y mol y mol
Cho hỗn hợp kim loại trên vào dd FeSO4 dư thì Mg tác dụng hết (Fe không tác dụng) theo phương trình sau:
Mg + FeSO4 → MgSO4 + Fe (3)
x mol x mol
→ khối lượng hỗn hợp tăng lên 1,68 gam là khối lượng chênh lệch giữa Fe mới tạo ra và Mg đã phản ứng. (sự tăng giảm khối lượng)
b) Ta có số mol của khí H2 là:
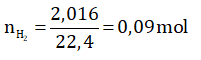
Theo phương trình (1); (2) và (3) ta có hệ phương trình :
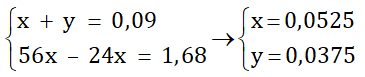
Vậy khối lượng của 2 kim loại trên là:
mMg = 0,0525.24 = 1,26 (gam)
mFe = 0,0375.56 = 2,1 (gam)
Bài tập tự luyện
Câu 1: Hoà tan hoàn toàn 1,45 gam hỗn hợp 3 kim loại Zn, Mg, Fe vào dung dịch HCl dư thu được 0,9916 lít H2 (đkc). Cô cạn dung dịch ta được m gam muối khan. Giá trị của m là
A. 4,29.
B. 2,87.
C. 3,19.
D. 3,87.
Câu 2: Hoà tan hoàn toàn 15,4 gam hỗn hợp Mg và Zn trong dung dịch HCl dư thấy có 7,437 lít khí thoát ra (ở đkc) và dung dịch A. Cô cạn dung dịch A được m gam muối khan. Giá trị của m là
A. 23,1.
B. 36,7.
C. 32,6.
D. 46,2.
Câu 3: Hoà tan hoàn toàn 33,1 gam hỗn hợp Mg, Fe, Zn vào trong dung dịch H2SO4 loãng dư thấy có 14,874 lít khí thoát ra (ở đkc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 78,7.
B. 75,5.
C. 74,6.
D. 90,7.
Câu 4: Cho 4,2 gam hỗn hợp gồm 2 kim loại Mg, Zn tác dụng hết với dung dịch HCl được 2,479 lít H2 (ở đkc). Khối lượng muối tạo ra trong dung dịch là
A. 9,75 (g).
B. 9,55 (g).
C. 11,3 (g).
D. 10,75 (g).
Câu 5: Hòa tan hoàn toàn 9,14 gam hợp kim Cu, Mg, Al bằng một lượng vừa đủ dung dịch HCl thu được 8,6765 lít khí X (đkc) và 2,54 gam rắn Y và dung dịch Z. Lọc bỏ chất rắn Y, cô cạn cẩn thận dung dịch Z thu được lượng muối khan là
A. 31,45 (g).
B. 33,99 (g).
C. 19,025 (g).
D. 56,3 (g).
Câu 6: Đốt cháy hoàn toàn 4,04 gam hỗn hợp ba kim loại sắt, nhôm, đồng trong không khí thu được 5,96 gam ba oxide. Hòa tan hết hỗn hợp ba oxide trên cần V lít dung dịch HCl 2 M. Giá trị của V là
A. 0,5.
B. 0,7.
C. 0,12.
D. 1.
Câu 7: Hoà tan hoàn toàn 14,6 gam hỗn hợp X gồm Al và Sn bằng dung dịch HCl (dư), thu được 6,1975 lít khí H2 (ở đkc). Thể tích khí O2 (ở đkc) cần để phản ứng hoàn toàn với 14,6 gam hỗn hợp X là
A. 3,09875 (L).
B. 1,85925 (L).
C. 4,958 (L).
D. 4,33825 (L).
Câu 8: Cho 10,5 gam hỗn hợp 2 kim loại Cu và Zn vào dung H2SO4 loãng dư, người ta thu được 2,479 lít khí (đkc). Thành phần % theo khối lượng của Cu và Zn lần lượt là
A. 61,9% và 38,1%.
B. 38,1% và 61,9%.
C. 65% và 35%.
D. 35% và 65%.
Câu 9: Hoà tan 2,64 gam hỗn hợp Fe và Mg bằng dung dịch HNO3 loãng, dư, thu được sản phẩm khử là 0,9916 lít (ở đkc) hỗn hợp khí gồm NO và N2, có tỉ khối so với H2 bằng 14,75. Thành phần % theo khối lượng của sắt trong hỗn hợp ban đầu là
A. 61,80%.
B. 61,82%.
C. 38,18%.
D. 38,20%.
Câu 10: Cho hỗn hợp gồm 2 gam Fe và 3 gam Cu vào dung dịch HNO3 thu được 0,4958 lít NO (sản phẩm khử duy nhất, ở đkc). Khối lượng muối trong dung dịch sau phản ứng là
A. 5,4 (g).
B. 8,76 (g).
C. 6,8 (g).
D. 8,72 (g).
Thi online KHTN 9 KNTTThi online KHTN 9 CDThi online KHTN 9 CTST
Xem thêm các dạng bài tập Hóa học lớp 9 có đáp án, hay khác:
Xem thêm các loạt bài Để học tốt Hóa học 9 hay khác:
- Giải bài tập Hóa học 9
- Giải sách bài tập Hóa 9
- Đề thi Hóa học 9
- Wiki 200 Tính chất hóa học
- Wiki 3000 Phản ứng hóa học quan trọng
Tủ sách VIETJACK luyện thi vào 10 cho 2k11 (2026):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Chuyên đề: Lý thuyết - Bài tập Hóa học lớp 9 có đáp án được biên soạn bám sát nội dung chương trình sgk Hóa học 9.
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Giải Tiếng Anh 9 Global Success
- Giải sgk Tiếng Anh 9 Smart World
- Giải sgk Tiếng Anh 9 Friends plus
- Lớp 9 Kết nối tri thức
- Soạn văn 9 (hay nhất) - KNTT
- Soạn văn 9 (ngắn nhất) - KNTT
- Giải sgk Toán 9 - KNTT
- Giải sgk Khoa học tự nhiên 9 - KNTT
- Giải sgk Lịch Sử 9 - KNTT
- Giải sgk Địa Lí 9 - KNTT
- Giải sgk Giáo dục công dân 9 - KNTT
- Giải sgk Tin học 9 - KNTT
- Giải sgk Công nghệ 9 - KNTT
- Giải sgk Hoạt động trải nghiệm 9 - KNTT
- Giải sgk Âm nhạc 9 - KNTT
- Giải sgk Mĩ thuật 9 - KNTT
- Lớp 9 Chân trời sáng tạo
- Soạn văn 9 (hay nhất) - CTST
- Soạn văn 9 (ngắn nhất) - CTST
- Giải sgk Toán 9 - CTST
- Giải sgk Khoa học tự nhiên 9 - CTST
- Giải sgk Lịch Sử 9 - CTST
- Giải sgk Địa Lí 9 - CTST
- Giải sgk Giáo dục công dân 9 - CTST
- Giải sgk Tin học 9 - CTST
- Giải sgk Công nghệ 9 - CTST
- Giải sgk Hoạt động trải nghiệm 9 - CTST
- Giải sgk Âm nhạc 9 - CTST
- Giải sgk Mĩ thuật 9 - CTST
- Lớp 9 Cánh diều
- Soạn văn 9 Cánh diều (hay nhất)
- Soạn văn 9 Cánh diều (ngắn nhất)
- Giải sgk Toán 9 - Cánh diều
- Giải sgk Khoa học tự nhiên 9 - Cánh diều
- Giải sgk Lịch Sử 9 - Cánh diều
- Giải sgk Địa Lí 9 - Cánh diều
- Giải sgk Giáo dục công dân 9 - Cánh diều
- Giải sgk Tin học 9 - Cánh diều
- Giải sgk Công nghệ 9 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 9 - Cánh diều
- Giải sgk Âm nhạc 9 - Cánh diều
- Giải sgk Mĩ thuật 9 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

