Lý thuyết Hóa trị, công thức hóa học (KHTN 7 Cánh diều Bài 6)
Với tóm tắt lý thuyết Khoa học tự nhiên 7 Bài 6: Hóa trị, công thức hóa học sách Cánh diều hay nhất, ngắn gọn sẽ giúp học sinh lớp 7 nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 7.
Lý thuyết Hóa trị, công thức hóa học (KHTN 7 Cánh diều Bài 6)
Chỉ từ 150k mua trọn bộ lý thuyết KHTN 7 Cánh diều (cả năm) bản word trình bày đẹp mắt, dễ dàng chỉnh sửa:
- B1: gửi phí vào tk:
1133836868- CT TNHH DAU TU VA DV GD VIETJACK - Ngân hàng MB (QR) - B2: Nhắn tin tới Zalo VietJack Official - nhấn vào đây để thông báo và nhận giáo án
I. Hóa trị
1. Khái niệm về hóa trị
- Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
- Thông thường, hóa trị của nguyên tố trong hợp chất cộng hóa trị bằng số electron mà nguyên tử nguyên tố đó góp chung với nguyên tử khác.
- Trong hợp chất, hóa trị của H luôn là I, hóa trị của O luôn là II.
Bảng hóa trị của một số nguyên tố
Tên nguyên tố |
Kí hiệu hóa học |
Hóa trị |
Hydrogen |
H |
I |
Lithium |
Li |
I |
Beryllium |
Be |
II |
Boron |
B |
III |
Carbon |
C |
IV, II |
Nitrogen (Nitơ) |
N |
III, II, IV,... |
Oxygen |
O |
II |
Fluorine |
F |
I |
Sodium (Natri) |
Na |
I |
Magnesium |
Mg |
II |
Aluminium (Nhôm) |
Al |
III |
Phosphorus |
P |
IV |
Sulfur(Lưu huỳnh) |
S |
II, IV, VI,... |
Chlorine |
Cl |
I |
Potassium (kali) |
K |
I |
Calcium |
Ca |
II |
Bảng hóa trị của một số nhóm nguyên tử
Tên nhóm |
Hóa trị |
Hydroxide (OH); Nitrate (NO3) |
I |
Sulfate (SO4), carbonate (CO3) |
II |
Phosphate (PO4) |
III |
2. Quy tắc hóa trị
- Quy tắc hóa trị: Khi các nguyên tử của hai nguyên tố A, B liên kết với nhau, tích giữa hóa trị và số nguyên tử của A bằng tích giữa hóa trị và số nguyên tử của B.
Ví dụ 1: Trong phân tử nước, hóa trị và số nguyên tử tham gia liên kết của H và O như sau:
Nguyên tố |
H |
O |
Hóa trị |
I |
II |
Số nguyên tử |
2 |
1 |
Tích hóa trị và số nguyên tử |
I × 1 = II × 1 |
|
Ví dụ 2: Trong phân tử silicon oxide (SiO2) hóa trị và số nguyên tử tham gia liên kết của Si và O như sau:
Nguyên tố |
Si |
O |
Hóa trị |
IV |
II |
Số nguyên tử |
1 |
2 |
Tích hóa trị và số nguyên tử |
IV × 1 = II × 2 |
|
II. Công thức hóa học
1. Công thức hóa học
- Công thức hóa học dùng để biểu diễn chất.
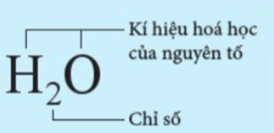
- Công thức hóa học gồm hai phần: Chữ và số
+ Phần chữ là kí hiệu hóa học của các nguyên tố.
+ Phần số được ghi dưới chân kí hiệu hóa học (gọi là chỉ số) là số nguyên tử của nguyên tố trong phân tử (nếu chỉ có một nguyên tử thì không ghi).
Ví dụ: Công thức hóa học của nước là H2O
- Công thức hóa học của các hợp chất có từ hai kí hiệu hóa học trở lên.
Ví dụ: NaCl, Na2O, H2SO4, CaCO3,...
- Công thức hóa học của đơn chất chỉ có một kí hiệu hóa học
+ Với phi kim phân tử thường có hai nguyên tử. Ví dụ: N2, H2, Cl2, O2,...
+ Với kim loại và một số phi kim, kí hiệu hóa học của nguyên tố được coi là công thức hóa học của đơn chất. Ví dụ: Na, K, Ba, Fe, C, S, P,...
2. Ý nghĩa của công thức hóa học
a) Công thức hóa học của một chất cho biết một số thông tin
- Nguyên tố tạo ra chất.
- Số nguyên tử của mỗi nguyên tố có trong một phân tử chất.
- Khối lượng phân tử của chất.
Ví dụ:Đường glucose có công thức hóa học là C6H12O6cho biết:
+ Glucose được tạo thành từ ba nguyên tố là C, H, O.
+ Trong một phân tử glucose có 6 nguyên tử C, 12 nguyên tử H, 6 nguyên tử O.
+ Khối lượng phân tử của glucose là:72 + 12 + 96 = 180 amu.
b) Biết công thức hóa học tính được phần trăm khối lượng các nguyên tố trong hợp chất theo các bước:
- Tính khối lượng mỗi nguyên tố có trong một phân tử hợp chất.
- Tính khối lượng phân tử
- Tính thành phần phần trăm khối lượng của nguyên tố theo công thức:
(Khối lượng nguyên tố : Khối lượng phân tử hợp chất) × 100%
Ví dụ: Tính phần trăm khối lượng của Ca, C, O trong CaCO3
Khối lượng của nguyên tố Ca trong CaCO3 là:
mCa = 1 × 40 amu = 40 amu
Khối lượng của nguyên tố C trong CaCO3 là:
mC = 1 × 12 amu = 12 amu
Khối lượng của nguyên tố O trong CaCO3 là:
mO = 3 × 16 = 48 amu
→ Khối lượng phân tử CaCO3 là: = 40 + 12 + 48 = 100 amu
Phần trăm về khối lượng của Ca trong CaCO3 là:
%mCa =
Phần trăm về khối lượng của C trong CaCO3 là:
%mC = = = 12%
Phần trăm về khối lượng của O trong CaCO3 là:
%mO =
c) Biết công thức hóa học và hóa trị của một nguyên tố, xác định được hóa trị của nguyên tố còn lại trong hợp chất
- Đặt hóa trị của nguyên tố chưa biết là a
- Xác định a dựa vào quy tắc hóa trị.
Ví dụ: Xác định hóa trị của Ba trong hợp chất BaO
Gọi hóa trị của Ba trong hợp chất là a
Vì O có hóa trị II nên ta có biểu thức:
a × 1 = II × 1 ⇒ a = II
Vậy trong hợp chất BaO, hóa trị của Ba là II, hóa trị của O là II.
3.Lập công thức hóa học của hợp chất khi biết hóa trị hoặc phần trăm khối lượng của các nguyên tố
a) Biết hóa trị của các nguyên tố, lập công thức hóa học của hợp chất tạo thành từ hai nguyên tố
Nếu hai nguyên tố A, B có hóa trị tương ứng là a, b thì công thức hóa học của hợp chất tạo thành từ A và B được xác định như sau:
- Đặt công thức hóa học của hợp chất là AxBy
- Áp dụng quy tắc hóa trị, xác định tỉ lệ
- Xác định x, y (x, y thường là những số nguyên nhỏ nhất thỏa mãn tỉ lệ trên)
Ví dụ: Lập công thức hóa học của hợp chất tạo bởi S hóa trị VI và O
Đặt công thức của hợp chất là SxOy
Theo quy tắc hóa trị, ta có: x × VI = y × II
Ta có tỉ lệ: . Lấy x = 1 và y = 3
Công thức hóa học của hợp chất là SO3
b) Xác định công thức hóa học của hợp chất khi biết phần trăm khối lượng của các nguyên tố và khối lượng phân tử của hợp chất.
Khi biết phần trăm khối lượng của hai nguyên tố A, B tạo nên hợp chất và khối lượng phân tử của chất đó. Xác định công thức hóa học theo các bước sau:
- Đặt công thức hóa học của chất là AxBy
- Tính khối lượng của A, B trong một phân tử chất.
- Tìm x, y.
Ví dụ:Hợp chất X được tạo thành bởi Fe và O có khối lượng phân tử là 160 amu. Biết phần trăm khối lượng của Fe trong X là 70%. Hãy xác định công thức hóa học của X.
Trả lời:
Đặt công thức hóa học của X là FexOy
Khối lượng nguyên tố Fe trong một phân tử X là (amu)
Khối lượng của nguyên tố S trong một phân tử X là160 – 112 = 48 (amu)
Ta có: 56 amu × x = 112 amu → x = 2
16 amu × y = 48 amu → y = 3
Vậy công thức hóa học của X là Fe2O3
Xem thêm tóm tắt lý thuyết Khoa học tự nhiên lớp 7 Cánh diều hay khác:
Xem thêm các tài liệu học tốt lớp 7 hay khác:
- Giải sgk Khoa học tự nhiên 7 Cánh diều
- Giải SBT Khoa học tự nhiên 7 Cánh diều
- Giải lớp 7 Cánh diều (các môn học)
- Giải lớp 7 Chân trời sáng tạo (các môn học)
- Giải lớp 7 Kết nối tri thức (các môn học)
Tủ sách VIETJACK shopee lớp 6-8 (2025):
Đã có app VietJack trên điện thoại, giải bài tập SGK, SBT Soạn văn, Văn mẫu, Thi online, Bài giảng....miễn phí. Tải ngay ứng dụng trên Android và iOS.
Theo dõi chúng tôi miễn phí trên mạng xã hội facebook và youtube:Loạt bài Giải bài tập Khoa học tự nhiên lớp 7 của chúng tôi được biên soạn bám sát nội dung sgk Khoa học tự nhiên 7 Cánh diều (NXB Đại học Sư phạm).
Nếu thấy hay, hãy động viên và chia sẻ nhé! Các bình luận không phù hợp với nội quy bình luận trang web sẽ bị cấm bình luận vĩnh viễn.
- Soạn văn 7 (hay nhất) - Cánh diều
- Soạn văn 7 (ngắn nhất) - Cánh diều
- Giải sgk Toán 7 - Cánh diều
- Giải Tiếng Anh 7 Global Success
- Giải Tiếng Anh 7 Friends plus
- Giải sgk Tiếng Anh 7 Smart World
- Giải Tiếng Anh 7 Explore English
- Giải sgk Khoa học tự nhiên 7 - Cánh diều
- Giải sgk Lịch Sử 7 - Cánh diều
- Giải sgk Địa Lí 7 - Cánh diều
- Giải sgk Giáo dục công dân 7 - Cánh diều
- Giải sgk Công nghệ 7 - Cánh diều
- Giải sgk Tin học 7 - Cánh diều
- Giải sgk Hoạt động trải nghiệm 7 - Cánh diều
- Giải sgk Âm nhạc 7 - Cánh diều




 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp

