Cách nhận biết nitric acid (HNO3) nhanh nhất
nitric acid có rất nhiều ứng dụng quan trọng. Phần lớn dùng để sản xuất phân đạm, ngoài ra còn được dùng để sản xuất thuốc nổ, thuốc nhuộm, dược phẩm,… Bài viết dưới đây sẽ giúp các em nhận biết axit này nhanh nhất.
Cách nhận biết nitric acid (HNO3)
I. Cách nhận biết nitric acid (HNO3)
- nitric acid là một axit mạnh và có tính oxi hóa rất mạnh.
- Cách nhận biết dung dịch axit HNO3 loãng:
+ Dùng quỳ tím: quỳ tím chuyển sang màu đỏ.
+ Dùng kim loại Cu: Đồng tan ra, dung dịch thu được có màu xanh, thoát ra khí màu nâu (thực tế là thoát ra khí không màu hóa nâu ngoài không khí).
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO↑ + 4H2O
2NO(không màu) + O2 → 2NO2 (nâu đỏ)
II. Mở rộng
- nitric acid tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm.
- nitric acid kém bền. Ngay ở điều kiện thường, khi có ánh sáng, dung dịch nitric acid đặc bị phân hủy một phần giải phóng khí NO2. Khí này tan trong dung dịch axit, làm cho dung dịch có màu vàng.
4HNO3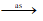 4NO2 + 2H2O + O2
4NO2 + 2H2O + O2
- Trong phòng thí nghiệm, thường có loại HNO3 đặc có nồng độ 68%.
- nitric acid bốc khói chứa 98% HNO3 thường được sử dụng trong ngành công nghiệp thuốc nổ.
III. Bài tập nhận biết nitric acid (HNO3)
Bài 1: Cho các hóa chất sau: quỳ tím, Cu, NaOH, phenolphtalein, BaCl2, AgNO3. Số chất có thể phân biệt hai dung dịch loãng: HNO3 và HCl đựng trong lọ bị mất nhãn?
A. 1
B. 2
C. 3
D. 4
Hướng dẫn giải:
- Quỳ tím, phenolphtalein, BaCl2, NaOH không phân biệt được.
- Cho Cu vào, hiện tượng thu được:
+ Đồng tan ra, dung dịch có màu xanh, có khí thoát ra: HNO3.
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO↑ + 4H2O
2NO + O2 → 2NO2
+ Không hiện tượng: HCl
- Cho AgNO3 vào, hiện tượng thu được:
+ Xuất hiện kết tủa trắng: HCl.
AgNO3 + HCl → AgCl↓ + HNO3
+ Không hiện tượng: HNO3.
Đáp án B
Bài 2: Chỉ dùng một hóa chất, hãy phân biệt các dung dịch sau: HNO3, NaNO3, H2SO4, Ba(OH)2 chứa trong các lọ mất nhãn.
Hướng dẫn giải:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng (trích mẫu thử).
- Cho các mẩu quỳ tím vào các mẫu thử, hiện tượng:
+ Quỳ tím chuyển sang màu đỏ: HNO3 và H2SO4 (nhóm I)
+ Quỳ tím chuyển sang màu xanh: Ba(OH)2.
+ Quỳ tím không đổi màu: NaNO3.
- Cho vài giọt dung dịch Ba(OH)2 vừa nhận biết ở trên vào các mẫu thử nhóm I, hiện tượng:
+ Xuất hiện kết tủa trắng: H2SO4.
H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
+ Không hiện tượng: HNO3.
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



