Cách nhận biết các khí hay gặp nhanh nhất
Cách nhận biết các khí hay gặp
1. Cách nhận biết khí H2
Khí hiđro là chất khí không màu, không mùi, không vị, tan rất ít trong nước và nhẹ nhất trong tất cả các khí. Qua bài bài viết sau đây, các em sẽ nắm được cách nhận biết khí H2 và biết thêm về ứng dụng của khí hiđro.
I. Cách nhận biết khí H2
Đặc điểm: Khí hiđro không tan trong nước và không phản ứng với dung dịch axit hay bazơ hay muối.
- Cách nhận biết: Cho đi qua CuO, đun nóng.
- Hiện tượng: Chất rắn màu đen chuyển dần sang màu đỏ
- Phương trình hóa học:
CuO + H2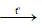 Cu↓+ H2O
Cu↓+ H2O
Ngoài ra: Khí H2 cháy trong không khí cho ngọn lửa có màu xanh nhạt và tỏa nhiều nhiệt.
2H2 + O2 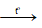 2H2O
2H2O
II. Mở rộng
Khí hiđro có nhiều ứng dụng trong đời sống và sản xuất như:
- Làm nhiên liệu cho động cơ tên lửa, nhiên liệu động cơ thay thế xăng.
- Hàn cắt kim loại với đèn xì oxi – hiđro.
- Là nguyên liệu để sản xuất amonia (NH3), hydrochloric acid (HCl) và nhiều hợp chất hữu cơ.
- Dùng bơm cho khinh khí cầu.
- Dùng làm chất khử để điều chế kim loại từ những oxit của chúng.
III. Bài tập nhận biết khí H2
Bài 1: Nêu phương pháp nhận biết các khí sau: H2, O2, CO2?
Hướng dẫn giải:
- Dẫn các khí đi qua CuO, đun nóng:
+ Chất rắn chuyển từ màu đen sang màu đỏ: H2
H2 + CuO 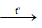 Cu↓ + H2O
Cu↓ + H2O
+ Không hiện tượng: O2 và CO2
- Sục hai khí còn lại qua dung dịch nước vôi trong, hiện tượng;
+ Dung dịch vẩn đục: CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
+ Không hiện tượng: O2.
Bài 2: Nêu phương pháp tách khí H2 bị lẫn tạp chất khí H2S?
Hướng dẫn giải:
- Dẫn hỗn hợp khí qua dung dịch NaOH dư, khí H2S phản ứng bị giữ lại, bay thoát ra ngoài là khí H2.
- Phương trình hóa học:
H2S + 2NaOHdư → Na2S + H2O
2. Cách nhận biết khí SO2
Bên cạnh một số tác hại thì SO2 cũng có tác dụng vượt trội trong sản xuất axit sunfuric và có công dụng tẩy trắng. Vậy khí SO2 được nhận biết như thế nào?
Để có lời giải đáp, các em hãy tham khảo ngay bài viết dưới đây.
I. Cách nhận biết khí SO2
Khí lưu huỳnhđioxit (SO2) (khí sunfurơ) là chất khí không màu, mùi hắc, nặng hơn không khí, tan nhiều trong nước.
- Cách nhận biết: Sục vào dung dịch brom hoặc dung dịch thuốc tím.
- Hiện tượng: Làm mất màu dung dịch brom hoặc mất màu dung dịch thuốc tím.
- Phương trình hóa học:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + 2MnSO4 + K2SO4
Ngoài ra, có thể nhận biết bằng cách sục khí từ từ đến dư vào dung dịch nước vôi trong (Ca(OH)2) hoặc Ba(OH)2
+ Hiện tượng: Dung dịch bị vẩn đục trắng, sau đó trở nên trong suốt.
+ Phương trình hóa học:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
CaSO3 + SO2 + H2O → Ca(HSO3)2
Lưu ý: Khí SO2 là khí độc, hít thở phải không khí có khí này sẽ gây viêm đường hô hấp. Do đó, khi tiến hành thí nghiệm phải cẩn thận và tiến hành trong tủ hút.
II. Mở rộng
SO2 được dùng để sản xuất H2SO4 trong công nghiệp, làm chất tẩy trắng và bột giấy, chất chống nấm mốc lương thực, thực phẩm,…
III. Bài tập nhận biết khí SO2
Bài 1: Có thể dùng lượng dư nước vôi trong để phân biệt hai khí CO2 và SO2 được hay không? Giải thích?
Hướng dẫn giải:
- Không thể dùng nước vôi trong để phân biệt hai khí CO2 và SO2 vì cả hai đều có phản ứng tạo kết tủa với Ca(OH)2 làm dung dịch vẩn đục trắng.
- Phương trình hóa học:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Bài 2: Hãy nhận biết hai chất khí sau bằng phương pháp hóa học: SO2 và O2. Viết các phương trình hóa học.
Hướng dẫn giải:
Dẫn lần lượt hai khí vào dung dịch nước vôi trong, nếu có kết tủa xuất hiện thì đó là SO2, không hiện tượng gì thì đó là khí O2.
Phương trình hóa học:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
3. Cách nhận biết khí Cl2
Ở điều kiện thường, clo là chất khí màu vàng lục, mùi xốc, rất độc, nó phá hoại niêm mạc của đường hô hấp. Clo tan trong nước gọi là nước clo có màu vàng nhạt. Khí clo tan nhiều trong các dung môi hữu cơ như benzene, ethanol, hexan cacbon tetraclorua,…Nhận biết khí clo bằng phương pháp hóa học như thế nào? Ứng dụng của clo là gì? Bài viết sau đây, sẽ cung cấp các kiến thức này cho các em.
I. Cách nhận biết khí Cl2
Một số cách nhận biết khí clo:
* Cách 1: Sục khí vào dung dịch AgNO3
- Hiện tượng: Xuất hiện kết tủa màu trắng.
- Phương trình hóa học:
Cl2 + H2O ⇄ HCl + HClO
HCl + AgNO3 → AgCl↓ + HNO3
* Cách 2: Sục khí Cl2 vào dung dịch KI cho thêm ít hồ tinh bột.
- Hiện tượng: Dung dịch hóa xanh đậm
- Phương trình hóa học:
Cl2 + 2KI → I2 + 2KCl
- Giải thích: Iot sinh ra tác dụng với hồ tinh bột tạo ra chất có màu xanh.
* Cách 3: Dùng quỳ tím ẩm
- Hiện tượng: giấy quỳ tím chuyển sang màu đỏ nhưng ngay sau đó bị mất màu.
- Giải thích: Do clo tác dụng với nước sinh ra HCl và HClO làm quỳ tím chuyển đỏ. Tuy nhiên, HClO có tính tẩy màu làm quỳ tím mất màu.
- Phương trình hóa học:
Cl2 + H2O ⇄ HCl + HClO
II. Mở rộng
Clo có rất nhiều ứng dụng trong sản xuất công nghiệp:
+ Điều chế nước Ja-ven.
+ Tẩy trắng vải, sợi, bột giấy.
+ Khử trùng nước sinh hoạt.
+ Điều chế nhựa PVC, chất dẻo, chất màu, cao su.
III. Bài tập nhận biết khí Cl2
Bài 1: Dùng thuốc thử nào để phân biệt ba khí sau: Cl2, SO2, CO2.
Hướng dẫn giải:
- Dẫn các khí qua dung dịch nước Br2, hiện tượng thu được:
+ Dung dịch Br2 mất màu: SO2
Phương trình hóa học:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
+ Không hiện tượng: Cl2 và CO2.
- Dẫn hai khí còn lại lần lượt qua dung dịch nước vôi trong dư, hiện tượng:
+ Dung dịch vẩn đục: CO2
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
+ Dung dịch không có hiện tượng: Cl2
Phương trình hóa học:
2Cl2 + 2Ca(OH)2 → CaCl2 + Ca(ClO)2 + 2H2O
Chú ý: Cl2 có phản ứng với Ca(OH)2 nhưng không cho hiện tượng có thể quan sát được.
Bài 2: Bằng phương pháp hóa học hãy nhận biết các chất khí sau: H2, HCl, Cl2, O2.
Hướng dẫn giải:
- Cho mẩu quỳ tím ẩm vào các lọ chứa các khí trên:
+ Quỳ tím chuyển sang màu đỏ: HCl
+ Quỳ tím chuyển sang màu đỏ, sau đó bị mất màu: Cl2
Cl2 + H2O ⇄ HCl + HClO
(HClO có tính tẩy màu nên làm mất màu quỳ tím)
+ Không hiện tượng: H2, O2.
- Dẫn lần lượt 2 khí qua ống nghiệm đựng CuO đun nóng, hiện tượng:
+ Chất rắn màu đen chuyển dần sang màu đỏ: H2
CuO + H2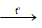 Cu↓ + H2O
Cu↓ + H2O
+ Không hiện tượng: O2.
4. Cách nhận biết khí CO2
Chúng ta biết khí carbonic là khí không màu, không vị, không mùi, không duy trì sự cháy, sự sống. Việc gia tăng lượng khí CO2 trong khí quyển gây nên hiệu ứng nhà kính. Trong hóa học, khí CO2 thường được đưa vào các bài tập nhận biết chất khí. Bài viết dưới đây sẽ giúp các em nắm được cách nhận biết khí này.
I. Cách nhận biết khí CO2
- Cách nhận biết: Dẫn khí vào dung dịch nước vôi trong (Ca(OH)2) hoặc dung dịch Ba(OH)2
- Hiện tượng: Dung dịch bị vẩn đục màu trắng, sau đó nếu khí dư, dung dịch lại trở nên trong suốt.
- Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
CaCO3 + CO2 dư + H2O → Ca(HCO3)2
Ngoài ra, chúng ta có thể nhận biết khí này bằng cách sử dụng que đóm đang cháy cho vào bình chứa khí CO2. Hiện tượng quan sát được đó là que đóm vụt tắt.
- Lưu ý: Khí CO2 làm quỳ tím ẩm chuyển sang màu đỏ.
II. Mở rộng
Khí CO2 được sử dụng khá phổ biến trong chế biến, bảo quản thực phẩm và trong công nghiệp:
- khí carbonic được sử dụng để chế tạo gas cho nhiều loại đồ uống có gas như coca, 7 up, pepsi,…
- CO2 ở dạng rắn hay còn gọi là đá khô. Đá khô có nhiệt độ rất thấp và không nóng chảy chuyển từ thể rắn sang thể lỏng mà thăng hoa (chuyển từ thể rắn sang thể khí). Đá khô thường được dùng để bảo quản thực phẩm.
- Được sử dụng trong bình chữa cháy.
- Là nguyên liệu dùng trong chế biến và sản xuất methanol, urê,…
III. Bài tập nhận biết khí CO2
Bài 1: Có 2 bình riêng biệt đựng các khí CO2 và SO2. Hãy trình bày cách phân biệt từng khí. Viết các phương trình hóa học.
Hướng dẫn giải:
- Dẫn hai khí lần lượt lội qua dung dịch nước brom nếu khí nào làm mất màu nước brom là SO2.
- Phương trình hóa học:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
Bài 2: Dùng phương pháp hóa học, hãy phân biệt các chất khí sau: CO2, H2, CO, SO2. Viết các phương trình hóa học.
Hướng dẫn giải:
- Cho quỳ tím ẩm vào các lọ đựng các khí trên, hiện tượng:
+ Quỳ tím chuyển sang màu đỏ: CO2, SO2 (nhóm 1)
CO2 + H2O ⇄ H2CO3
SO2 + H2O ⇄ H2SO3
+ Quỳ tím không đổi màu: CO, H2 (nhóm 2)
- Dẫn hai khí ở nhóm 1 lần lượt lội qua dung dịch nước brom, hiện tượng:
+ Dung dịch brom mất màu: SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
+ Không hiện tượng: CO2
- Dẫn 2 khí ở nhóm 2 qua CuO đun nóng, khí (hoặc hơi) thu được dẫn qua dung dịch nước vôi trong dư, hiện tượng:
+ Chất rắn chuyển từ màu đen sang màu đỏ, dung dịch xuất hiện vẩn đục → Khí ban đầu là CO.
CO + CuO đen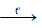 Cu đỏ + CO2↑
Cu đỏ + CO2↑
CO2 + Ca(OH)2 → CaCO3↓ + H2O
+ Chất rắn chuyển từ màu đen sang màu đỏ, dung dịch không hiện tượng → Khí ban đầu là khí H2.
H2 + CuO đen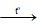 Cu đỏ + H2O
Cu đỏ + H2O
5. Cách nhận biết khí hiđro clorua (HCl)
Hiđro clorua (HCl) là khí không màu, mùi xốc, nặng hơn không khí và tan nhiều trong nước tạo thành dung dịch hydrochloric acid. Bài viết sau đây, sẽ cung cấp cho các em cách nhận biết khí này.
I. Cách nhận biết hiđroclorua
- Cách nhận biết: Dùng quỳ tím ẩm
- Hiện tượng: Quỳ tím ẩm chuyển sang màu đỏ.
Ngoài ra, có thể nhận biết khí hiđro clorua bằng cách sục khí vào dung dịch AgNO3, xuất hiện kết tủa màu trắng.
AgNO3 + HCl → AgCl↓ + HNO3
II. Mở rộng
- Trong phòng thí nghiệm, có thể điều chế khíhiđro clorua bằng cách cho tinh thể NaCl tác dụng với axit H2SO4 đậm đặc và đun nóng (phương pháp sunfat). Sau đó, hấp thụ vào nước để thu được dung dịch hydrochloric acid.
NaCl + H2SO4 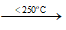 NaHSO4 + HCl ↑
NaHSO4 + HCl ↑
Ở nhiệt độ cao hơn tạo ra Na2SO4 và khí HCl:
2NaCl + H2SO4 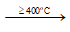 Na2SO4 + 2HCl ↑
Na2SO4 + 2HCl ↑
- Trong công nghiệp, người ta đốt khí H2 trong khí quyển Cl2 (Cl2 và H2 đều là sản phẩm của quá trình điện phân dung dịch NaCl có màng ngăn.
H2 + Cl2 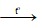 2HCl
2HCl
III. Bài tập nhận biết khí hiđro clorua
Bài 1: Phân biệt các khí sau bằng phương pháp hóa học: Cl2, HCl, NH3.
Hướng dẫn giải:
- Dùng quỳ tím ẩm để phân biệt các khí, hiện tượng thu được:
+ Quỳ tím chuyển sang màu đỏ: HCl
+ Quỳ tím chuyển sang màu đỏ, sau đó mất màu: Cl2
Cl2 + H2O ⇄ HCl + HClO
(HClO có tính tẩy màu nên làm mất màu quỳ tím)
+ Quỳ tím chuyển sang màu xanh: NH3
NH3 + H2O ⇄ NH4+ + OH-
→ Dung dịch có môi trường bazơ nên làm quỳ tím chuyển sang màu xanh.
Bài 2: Để phân biệt hai khí HCl và SO2 cần dùng thuốc thử:
A. Quỳ tím ẩm
B. Dung dịch KOH
C. Dung dịch Ba(OH)2
D. Dung dịch phenolphtalein
Hướng dẫn giải:
Thuốc thử cần dùng là dung dịch Ba(OH)2, hiện tượng:
+ Xuất hiện kết tủa trắng: SO2
SO2 + Ba(OH)2 → BaSO3↓ + H2O
Nếu SO2 sục dư, kết tủa tan dần:
SO2 + BaSO3 + H2O → Ba(HSO3)2
+ Không hiện tượng: HCl
2HCl + Ba(OH)2 → BaCl2 + 2H2O
Chú ý: HCl có phản ứng với Ba(OH)2 nhưng không cho hiện tượng có thể quan sát được.
→ Đáp án C.
6. Cách nhận biết khí NH3
amonia là chất khí không màu, có mùi khai và xốc, nhẹ hơn không khí. Khí amonia tan rất nhiều trong nước: Ở điều kiện thường, 1 lít nước hòa tan được khoảng 800 lít khí amonia. Dung dịch thu được gọi là dung dịch amonia. Trong các bài toán nhận biết các khí, nhận biết NH3 bằng cách nào? Bài viết dưới đây, sẽ giúp các em nắm được cách nhận biết khí này.
I. Cách nhận biết khí NH3
- Cách nhận biết: Dùng quỳ tím ẩm
- Hiện tượng: Quỳ tím ẩm hóa xanh.
- Giải thích: Khi tan trong nước, NH3 kết hợp với ion của nước, tạo thành ion amoni và giải phóng ion hiđroxit OH-, làm cho dung dịch có tính bazơ và dẫn điện:
NH3 + H2O ⇄ NH4+ + OH-
Ngoài ra, có thể nhận biết khí NH3 bằng cách cho tác dụng với khí HCl, thấy có khói trắng xuất hiện.
NH3 (k) + HCl(k) → NH4Cl(r)
Lưu ý: Khí NH3 có mùi khai đặc trưng, kích thích mắt và hệ thống hô hấp rất mạnh. Lượng rất nhỏ khí này trong không khí cũng kiến chúng ta nhận ra ngay bằng mùi khai rất đặc trưng.
II. Mở rộng
amonia được sử dụng chủ yếu để sản xuất nitric acid, phân đạm như urê, amoni nitrate, amoni sunfat,…; điều chế hiđrazin N2H4 làm nhiên liệu cho tên lửa. amonia lỏng được dùng làm chất làm lạnh trong thiết bị lạnh.
III. Bài tập nhận biết khí NH3
Bài 1: Để nhận biết các khí: CO2, SO2, NH3 dùng các thuốc thử nào sau đây?
A. Dung dịch HCl, dung dịch NaOH.
B. Quỳ tím ẩm, nước Br2.
C. Quỳ tím ẩm, dung dịch HCl.
D. Quỳ tím ẩm, dung dịch NaOH.
Hướng dẫn giải:
- Dùng quỳ tím ẩm, hiện tượng:
+ Quỳ tím chuyển đỏ: CO2, SO2
+ Quỳ tím chuyển xanh: NH3
- Sục hai khí còn lại qua dung dịch nước brom, hiện tượng:
+ Dung dịch brom mất màu: SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
+ Không hiện tượng: CO2
→ Đáp án B
Bài 2: Cho các khí sau: NH3, H2S, HCl, CO, SO2. Số chất khí làm quỳ tím ẩm đổi màu là:
A. 2
B. 3
C. 4
D. 5
Hướng dẫn giải:
Quỳ tím ẩm đổi sang màu xanh: NH3
Quỳ tím ẩm đổi sang màu đỏ: H2S, HCl, SO2
→ Có 4 chất làm quỳ tím ẩm đổi màu.
→ Đáp án C
7. Cách nhận biết khí NO2
NO2 là chất khí độc hại gây ảnh hưởng đến sức khỏe con người và sinh vật. Làm thế nào để nhận ra khí NO2? Bài viết sau sẽ giúp các em trả lời câu hỏi này.
I. Cách nhận biết khí NO2
- Đặc điểm của khí NO2 là có màu nâu đỏ.
- Cách nhận biết: Làm lạnh rồi đưa về nhiệt độ ban đầu.
- Hiện tượng: Khi làm lạnh màu nâu đỏ nhạt dần sau đó mất màu, khi hết làm lạnh lại xuất hiện màu nâu đỏ.
2NO2 (nâu đỏ) ⇄ N2O4 (không màu)
- Ngoài ra, có thể nhận biết bằng cách: Sục khí vào nước, sau đó cho mẩu Cu vào dung dịch. Thấy mẩu đồng tan dần, dung dịch chuyển sang màu xanh, thoát ra khí không màu hóa nâu trong không khí.
Phương trình hóa học:
4NO2 + O2 + H2O → 4HNO3
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Khí NO không màu sinh ra hóa nâu ngay ngoài không khí:
2NO (không màu) + O2 → 2NO2 (nâu đỏ)
- Lưu ý: Khí NO2 gây độc cho con người. Nếu hàm lượng khí NO2 trong cơ thể cao sẽ gây hiện tượng thiếu oxy trong máu dễ dẫn đến tình trạng cơ thể choáng váng, thậm chí có thể ngất hoặc tử vong.
II. Mở rộng
Khí NO2 cũng có thể tạo mưa axit. Khi khí NO2 gặp hơi nước trong không khí sẽ tạo thành axit nitric (HNO3).
Khí NO2 cũng có vài công dụng như:
+ Trong sản xuất thịt chế biến sẵn người ta thường bổ sung NO2 để ức chế sự sinh sôi phát triển của vi khuẩn trong thịt, giúp thịt lâu hư tránh các trường hợp ngộ độc thực phẩm do bị ôi thiu.
+ Ngoài ra, việc bổ sung NO2 có tác dụng giúp thịt có màu đỏ tươi, đẹp bắt mắt, giữ được màu đỏ tươi dù đã qua chế biến ở nhiệt độ cao và làm thịt có mùi đặc trưng hơn.
III. Bài tập nhận biết khí NO2
Bài 1: Hãy nêu phương pháp nhận biết các khí sau: CO2, Cl2, NO2, H2, SO2.
Hướng dẫn giải:
- Dựa vào màu sắc của khí, ta nhận biết được:
+ Khí NO2 có màu nâu đỏ.
+ Khí Cl2 có màu vàng lục.
+ Các khí còn lại (CO2, H2, SO2) không màu.
- Dẫn các khí qua dung dịch nước brom, hiện tượng:
+ Dung dịch nước brom mất màu: SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
+ Không hiện tượng: H2, CO2
- Dẫn lần lượt hai khí còn lại qua dung dịch nước vôi trong, hiện tượng:
+ Dung dịch xuất hiện vẩn đục: CO2
+ Không hiện tượng: H2.
Bài 2: Phân biệt các khí sau: NO2, CO2, CO bằng phương pháp hóa học?
Hướng dẫn giải:
- Dẫn các khí lần lượt qua CuO đun nóng, hiện tượng thu được:
+ Chất rắn màu đen chuyển dần sang màu đỏ: CO
CO + CuO 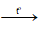 Cu + CO2↑
Cu + CO2↑
+ Không hiện tượng: NO2, CO2
- Sục hai khí còn lại qua dung dịch nước vôi trong:
+ Dung dịch xuất hiện vẩn đục: CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
+ Không thấy khí thoát ra: NO2.
4NO2 + 2Ca(OH)2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
8. Cách nhận biết khí CH4
khí methane (CH4) là một chất khí không màu, không mùi, không vị. Đặc biệt dễ bắt cháy, tạo ra ngọn lửa màu xanh. Bài viết dưới đây, cung cấp cho các em cách nhận biết khí methane.
I. Cách nhận biết khí CH4
- Cách nhận biết: Cho tác dụng với khí clo trong điều kiện chiếu sáng. Sản phẩm sau phản ứng thử bằng quỳ tím ẩm.
- Hiện tượng: Quỳ tím ẩm hóa đỏ.
- Giải thích: CH4 tác dụng với clo sinh ra khí HCl. Khí này làm quỳ tím ẩm hóa đỏ.
- Phương trình hóa học:
CH4 + Cl2 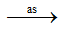 CH3Cl + HCl
CH3Cl + HCl
II. Mở rộng
khí methane được ứng dụng vào đời sống sinh hoạt và sản xuất của con người rất nhiều:
+ Là một nhiên liệu quan trọng trong đời sống.
+ Là nguyên liệu để điều chế khí H2, bột than và nhiều chất khác.
III. Bài tập nhận biết khí CH4
Bài 1:Phân biệt các bình mất nhãn đựng các khí sau: CH4, CO2, SO2. Viết các phương trình hóa học.
Hướng dẫn giải:
Dùng quỳ tím ẩm, ta thu được hiện tượng:
+ Quỳ tím chuyển sang màu đỏ: CO2 và SO2 (nhóm 1).
CO2 +H2O ⇄ H2CO3
SO2 + H2O ⇄ H2SO3
+ Quỳ tím không đổi màu: CH4
- Các khí ở nhóm 1 lần lượt sục qua dung dịch nước brom:
+ Dung dịch nước brom mất màu: SO2
SO2 + Br2 + 2H2O → 2HBr + H2SO4
+ Không hiện tượng: CO2
Bài 2: Phân biệt hai khí CH4 và C2H2 bằng phương pháp hóa học?
Hướng dẫn giải:
Sục hai khí vào dung dịch AgNO3/NH3, hiện tượng:
+ Xuất hiện kết tủa màu vàng: C2H2
CH ≡ CH + 2AgNO3 + 2NH3 → Ag - C ≡ C - Ag ↓ + 2NH4NO3
+ Không hiện tượng: CH4
9. Cách nhận biết khí C2H4
Etilen được sử dụng rộng rãi trong ngành công nghiệp hóa chất, với sản lượng tiêu thụ cả trăm triệu tấn/ năm.Trong chương trình học, khí etilen thường xuyên được đưa vào trong các bài tập nhận biết khí mất nhãn. Vậy có những phương pháp nào để nhận ra khí này? Bài viết dưới đây sẽ giúp các em tìm hiểu về vấn đề này.
I. Cách nhận biết khí C2H4
- Cách nhận biết: Dẫn khí vào dung dịch brom hoặc dung dịch thuốc tím.
- Hiện tượng: Làm mất màu dung dịch brom hoặc mất màu dung dịch thuốc tím.
- Phương trình hóa học:
C2H4 + Br2 → C2H4Br2
3CH2 = CH2 + 2KMnO4 + 4H2O →3HO – CH2 – CH2 – OH + 2MnO2↓ + 2KOH
II. Mở rộng
Ngày nay, khí etilen C2H4 được nhiều người biết đến nhiều hơn bởi tác dụng và cách ứng dụng rộng rãi etilen trong cách ngành công nghiệp hóa chất và mức sản lượng trên toàn thế giới.
+ Khí C2H4 là nguyên liệu được sử dụng chủ yếu trong sản xuất các loại polymer.
+ Ngoài ra, khí etilen có tác dụng rất nhiều trong nông nghiệp để trái cây chín đều, tăng giá trị thương phẩm, màu sắc và chất lượng.
+ Khí C2H4 có tác dụng kích thích quá trình tạo mủ và làm cho mủ chậm đông, giúp mủ chảy lâu hơn. Từ đó làm tăng năng suất của mủ cao su.
III. Bài tập nhận biết
Bài 1: Trình bày phương pháp hóa học để phân biệt methane và etilen?
Hướng dẫn giải:
- Lần lượt dẫn từng khí qua từng ống nghiệm đựng dung dịch brom, hiện tượng quan sát được:
+ Dung dịch brom nhạt màu: etilen
Phương trình hóa học:
C2H4 + Br2 → C2H4Br2
+ Không hiện tượng: methane.
Bài 2: Hãy trình bày phương pháp hóa học để phân biệt các chất khí được đựng trong các bình riêng biệt không nhãn: CO2, CH4, C2H4, C2H2. Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Dẫn lần lượt từng khí qua dung dịch nước vôi trong:
+ Dung dịch xuất hiện vẩn đục: CO2
CO2 + Ca(OH)2 → CaCO3↓ + H2O
+ Không hiện tượng: CH4, C2H4, C2H2.
- Dẫn lẫn lượt ba khí còn lại qua dung dịch brom, hiện tượng:
+ Dung dịch brom mất màu: C2H4 và C2H2.
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
+ Không hiện tượng: CH4.
- Dẫn lần lượt hai khí còn lại qua dung dịch AgNO3/NH3, hiện tượng:
+ Xuất hiện kết tủa màu vàng nhạt: C2H2
CH ≡ CH + 2AgNO3 + 2NH3 → Ag - C ≡ C - Ag↓ + 2NH4NO3
+ Không hiện tượng: C2H4.
- Dán nhãn các bình khí đã nhận biết.
10. Cách nhận biết khí C2H2
Khí C2H2 có tên thay thế là etin nhưng chúng ta thường gọi nó là acetylene. Khí acetylene không tan trong nước và nhẹ hơn nước. Khí acetylene có những ứng dụng gì? Nhận biết khí này như thế nào? Chúng ta cùng tìm hiểu ở bài viết dưới đây nhé!
I. Cách nhận biết C2H2
Một số cách nhận biết C2H2:
- Cách 1: Sử dụng dung dịch brom
Hiện tượng: Mất màu dung dịch brom
Phương trình hóa học:
C2H2 + 2Br2 (nâu đỏ) → C2H2Br4 (không màu)
- Cách 2: Sử dụng dung dịch thuốc tím (KMnO4).
Hiện tượng: Mất màu dung dịch thuốc tím
Phương trình hóa học:
3CH ≡ CH + 8KMnO4 + 4H2O → 3HOOC – COOH + 8MnO2↓ + 8KOH
- Cách 3: Sử dụng dung dịch AgNO3/NH3
Hiện tượng: Xuất hiện kết tủa màu vàng
Phương trình hóa học:
CH ≡ CH + 2AgNO3 + 2NH3 → Ag - C ≡ C - Ag↓ + 2NH4NO3
II. Mở rộng
Khí acetylene được dùng làm nhiên liệu và nguyên liệu.
+ Khi cháy, acetylene tỏa nhiều nhiệt nên được dùng trong đèn xì oxi – acetylene để hàn, cắt kim loại.
+ Từ acetylene có thể điều chế được nhiều chất đầu quan trọng cho các quá trình tổng hợp hữu cơ.
III. Bài tập nhận biết khí C2H2
Bài 1: Nêu phương pháp phân biệt 3 chất khí sau: methane, etilen, acetylene? Viết phương trình hóa học.
Hướng dẫn giải:
- Dẫn lần lượt từng khí qua dung dịch brom, hiện tượng:
+ Dung dịch brom mất màu: etilen và acetylene.
C2H4 + Br2 → C2H4Br2
C2H2 + 2Br2 → C2H2Br4
+ Không hiện tượng: methane.
- Dẫn hai khí còn lại qua dung dịch AgNO3/NH3, hiện tượng:
+ Xuất hiện kết tủa màu vàng: acetylene
CH ≡ CH + 2AgNO3 + 2NH3 → Ag - C ≡ C - Ag↓ + 2NH4NO3
+ Không hiện tượng: etilen
Bài 2:Để nhận biết các bình riêng biệt đựng các khí không màu sau đây: SO2, C2H2, NH3 ta có thể dùng hoá chất nào sau đây ?
A. Dung dịch AgNO3/NH3.
B. Dung dịch Ca(OH)2.
C. Quỳ tím ẩm.
D. Dung dịch NaOH.
Hướng dẫn giải:
Ta dùng quỳ tím ẩm để nhận biết các bình riêng biệt đựng các khí. Khi cho quỳ tím ẩm vào các bình khí:
- Quỳ tím chuyển màu đỏ → SO2.
SO2 + H2O H2SO3
- Quỳ tím chuyển màu xanh → NH3
- Quỳ tím không chuyển màu → C2H2.
→ Đáp án C
11. Cách nhận biết khí methylamine, ethylamine, dimethylamine, Trimethylamine
methylamine, ethylamine, dimethylamine, Trimethylamine là những chất khí có mùi khai khó chịu, tan nhiều trong nước. Trong các bài toán nhận biết các chất khí có một trong những khí trên thì chúng ta phải dùng thuốc thử nào? Để có câu trả lời thì các em hãy đọc bài viết dưới đây nhé!
I. Cách nhận biết khí methylamine, ethylamine, dimethylamine, Trimethylamine
- Cách nhận biết: Dùng quỳ tím ẩm hoặc dung dịch phenolphtalein.
- Hiện tượng: Quỳ tím ẩm hóa xanh hoặc dung dịch phenolphtalein chuyển thành màu hồng.
- Giải thích: Các khí này khi tan trong nước, phản ứng với nước tương tự NH3, sinh ra ion . Dung dịch có môi trường bazơ làm quỳ tím chuyển thành màu xanh, hoặc dung dịch phenolphtalein chuyển thành màu hồng.
- Phương trình hóa học:
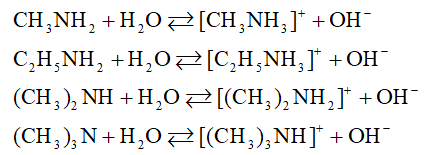
- Lưu ý: Các khí trên đều rất độc.
II. Mở rộng
Mùi tanh của cá là do hỗn hợp một số amin, nhiều nhất là Trimethylamine và 1 số chất khác gây nên. Để khử mùi tanh cần chất có tính axit để trung hòa amin như giấm, khế chua,…
III. Bài tập nhận biết khí methylamine, ethylamine, dimethylamine, Trimethylamine
Bài 1: Trình bày phương pháp hóa học để phân biệt hai chất khí CH4 và CH3NH2?
Hướng dẫn giải:
- Cho quỳ tím ẩm vào các lọ khí, hiện tượng:
+ Quỳ tím ẩm chuyển sang màu xanh: CH3NH2
CH3NH2 + H2O ⇄ [CH3NH3]+ + OH-
+ Quỳ tím ẩm không đổi màu: CH4.
Bài 2:Cho các khí sau: ethylamine, HCl, CO, SO2. Hãy trình bày phương pháp nhận biết các khí trên. Viết phương trình hóa học minh họa.
Hướng dẫn giải:
- Dùng quỳ tím ẩm, ta thu được hiện tượng:
+ Quỳ tím ẩm chuyển sang màu đỏ: HCl, SO2 (nhóm I)
SO2 + H2O → H2SO3
+ Quỳ tím chuyển sang màu xanh là ethylamine
C2H3NH2 + H2O ⇄ [ C2H3NH3]+ + OH-
+ Không hiện tượng: CO
- Sục hai khí ở nhóm I qua dung dịch Ba(OH)2 dư, hiện tượng:
+ Dung dịch xuất hiện kết tủa trắng: SO2
SO2 + Ba(OH)2 → BaSO3↓ + H2O
+ Không hiện tượng: CO
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



