Cách nhận biết muối axit nhanh nhất
Cách nhận biết muối axit
Muối gồm một hay nhiều cation kim loại (hoặc amoni) liên kết với một hay nhiều anion gốc axit. Khi dựa vào thành phần của muối thì muối được phân làm hai loại là muối axit và muối trung hòa. Muối axit là muối mà trong gốc axit còn nguyên tử hiđro có thể phân li ra ion. Một số muối axit thường gặp như NaHSO4, NaHCO3, Ca(HCO3)2,… Bài viết dưới đây, sẽ đề cập đến vấn đề nhận biết muối axit thường gặp.
I. Cách nhận biết một số muối axit hay gặp
- Nhận biết muối hydrocarbon?t (HCO3-):
+ Dùng dung dịch axit loãng như HCl và H2SO4 …
Hiện tượng: Thấy có bọt khí .
Ví dụ:
NaHCO3 + HCl → NaCl + CO2↑ + H2O
+ Dùng dung dịch Ba(OH)2 hoặc Ca(OH)2
Hiện tượng: Xuất hiện kết tủa trắng
Ví dụ:
KHCO3 + Ba(OH)2 → BaCO3↓ + KOH + H2O
+ Nếu là muối Ca(HCO3)2 và Ba(HCO3)2 … có thể đun nóng dung dịch muối.
Hiện tượng: Thấy có bọt khí và có thêm kết tủa trắng
Ví dụ:
Ba(HCO3)2 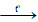 BaCO3↓ + CO2 + H2O
BaCO3↓ + CO2 + H2O
- Nhận biết muối hiđrosunfit:
+ Dùng dung dịch axit loãng như HCl, H2SO4 loãng
Hiện tượng: Thấy có khí không màu, mùi hắc thoát ra.
Ví dụ:
NaHSO3 + HCl → NaCl + SO2 ↑ + H2O
+ Dùng dung dịch Ba(OH)2 hoặc Ca(OH)2
Hiện tượng: Xuất hiện kết tủa trắng
Ví dụ:
KHSO3 + Ba(OH)2 → BaSO3↓ + KOH + H2O
- Nhận biết muối hiđrosunfat : thường dùng dung dịch Ba(OH)2
Hiện tượng: Xuất hiện kết tủa trắng
Ví dụ:
KHSO4 + Ba(OH)2 → BaSO4↓ + KOH + H2O
II. Mở rộng
Các muối axit gần như có đầy đủ tính chất của một muối và một axit.
+ Phản ứng trung hòa
NaHCO3 + NaOH → Na2CO3 + H2O
+ Phản ứng với muối
2NaHSO4 + Na2CO3 → 2Na2SO4 + CO2 ↑+ H2O
+ Phản ứng giữa hai muối axit
NaHSO4 + NaHCO3 → Na2SO4 + CO2 ↑+ H2O
+ Phản ứng giữa muối axit và axit
Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 ↑+ 2H2O
III. Bài tập nhận biết muối axit
Bài 1: Muối nào sau đây là muối axit?
A. NH4NO3.
B. Na3PO4.
C. Ca(HCO3)2.
D. CH3COOK.
Hướng dẫn giải:
Đáp án C
Muối Ca(HCO3)2 là muối axit vì trong gốc axit còn nguyên tử H có thể phân li ra ion.
Bài 2: Chỉ dùng thuốc thử nào dưới đây, có thể phân biết hai dung dịch NaHCO3 và NaHSO4?
A. Ba(OH)2
B. NaOH
C. NaCl
D. BaCl2
Hướng dẫn giải:
Đáp án D
Khi dùng chất nhận biết là BaCl2
+ Xuất hiện kết tủa trắng: NaHSO4
Phương trình hóa học:
NaHSO4 + BaCl2 → BaSO4↓ + NaCl + HCl
+ Không hiện tượng: NaHCO3
Bài 3: Không dùng thêm thuốc thử nào khác, hãy phân biệt các dung dịch sau, chứa trong lọ mất nhãn: NaHSO4, KHCO3, Na2SO3, Ba(HCO3)2
Hướng dẫn giải:
- Lấy mẫu các dung dịch, đánh số tương ứng và tiến hành đun nóng
+ Xuất hiện kết tủa trắng, có bọt khí: Ba(HCO3)2
Ba(HCO3)2 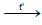 BaCO3↓ + CO2 ↑ + H2O
BaCO3↓ + CO2 ↑ + H2O
+ Xuất hiện bọt khí: KHCO3
2KHCO3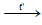 K2CO3 + CO2 ↑ + H2O
K2CO3 + CO2 ↑ + H2O
+ Không hiện tượng: NaHSO4 và Na2SO3
- Cho Ba(HCO3)2 đã nhận biết được vào các chất còn lại
+ Xuất hiện kết tủa trắng và có khí thoát ra: NaHSO4
2NaHSO4 + Ba(HCO3)2 → BaSO4↓ + Na2SO4 + 2CO2 ↑+ 2H2O
+ Xuất hiện kết tủa trắng: Na2SO3
Ba(HCO3)2 + Na2SO3 → BaSO3↓ + 2NaHCO3
Xem thêm cách nhận biết các chất hóa học nhanh, chi tiết khác:
Sách VietJack thi THPT quốc gia 2025 cho học sinh 2k7:
- Đề thi lớp 1 (các môn học)
- Đề thi lớp 2 (các môn học)
- Đề thi lớp 3 (các môn học)
- Đề thi lớp 4 (các môn học)
- Đề thi lớp 5 (các môn học)
- Đề thi lớp 6 (các môn học)
- Đề thi lớp 7 (các môn học)
- Đề thi lớp 8 (các môn học)
- Đề thi lớp 9 (các môn học)
- Đề thi lớp 10 (các môn học)
- Đề thi lớp 11 (các môn học)
- Đề thi lớp 12 (các môn học)
- Giáo án lớp 1 (các môn học)
- Giáo án lớp 2 (các môn học)
- Giáo án lớp 3 (các môn học)
- Giáo án lớp 4 (các môn học)
- Giáo án lớp 5 (các môn học)
- Giáo án lớp 6 (các môn học)
- Giáo án lớp 7 (các môn học)
- Giáo án lớp 8 (các môn học)
- Giáo án lớp 9 (các môn học)
- Giáo án lớp 10 (các môn học)
- Giáo án lớp 11 (các môn học)
- Giáo án lớp 12 (các môn học)






 Giải bài tập SGK & SBT
Giải bài tập SGK & SBT
 Tài liệu giáo viên
Tài liệu giáo viên
 Sách
Sách
 Khóa học
Khóa học
 Thi online
Thi online
 Hỏi đáp
Hỏi đáp



